
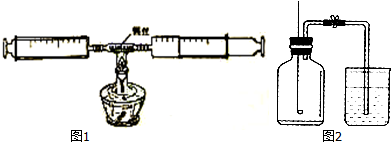
分析 (1)在加热的条件下,铜丝与空气中的氧气反应生成黑色的氧化铜,停止加热冷却至室温,注射器内气体的体积大约减少了$\frac{1}{5}$,由此可以得出:空气中氧气的体积分数大约为$\frac{1}{5}$;
(2)根据碳燃烧生成物是二氧化碳气体,瓶内气压不变解答.
解答 解:
(1)在加热的条件下,铜丝与空气中的氧气反应生成黑色的氧化铜,反应的化学方程式为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;停止加热冷却至室温,注射器内气体的体积大约减少了$\frac{1}{5}$,由此可以得出:空气中氧气的体积分数大约为$\frac{1}{5}$;
(2)测空气中氧气的含量主要是根据物质燃烧消耗空气中的气体造成气压减小,减小的体积就是氧气的体积,故生成物中不能有气体,用碳代替红磷,碳燃烧生成物是二氧化碳气体,瓶内气压不变,故不会进入水;
乙同学要想得到正确的实验结论必须消耗掉生成的二氧化碳气体,故可选择氢氧化钠溶液吸收二氧化碳;
故答案为:
(1)①红色物质逐渐变成黑色 ②2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO ③约$\frac{1}{5}$ ④空气中氧气的体积分数大约为$\frac{1}{5}$;
(2)碳燃烧生成物是二氧化碳气体,瓶内气压不变;氢氧化钠.
点评 本题主要考查了用铜丝测定空气里氧气含量的实验原理、操作步骤、实验现象、反应的化学方程式、实验结论等.由于装有铜丝的玻璃管和注射器的前端较细,为了使注射器里的空气中的氧气能充分的与铜丝反应,在试验过程中应来回交替推动注射器的活塞.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:初中化学 来源: 题型:填空题
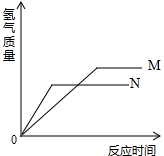 等质量的M、N两种金属,分别与相同质量分数、等质量的稀盐酸反应成生氢气质量和反应时间的关系如图所示.
等质量的M、N两种金属,分别与相同质量分数、等质量的稀盐酸反应成生氢气质量和反应时间的关系如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 金刚石是一种单质 | |
| B. | 金刚石、石墨都是由碳原子构成的 | |
| C. | 金刚石与石墨的物理性质不同是由于它们的结构不同 | |
| D. | 石墨与金刚石之间可以相互转化,它们之间的转化属于物理变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
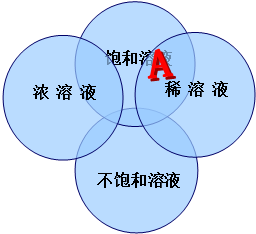
| A. | 图中A处的含义饱和的稀溶液 | |
| B. | 浓溶液一定是饱和溶液,稀溶液一定不饱和 | |
| C. | 在一定的温度下向饱和的硝酸钾溶液中加入少量的硝酸钾晶体,晶体不再溶解 | |
| D. | 同一温度下,同种溶质的饱和溶液一定比它的不饱和溶液浓 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验编号 | 实验操作 | 实验现象 |
| ① | 加入适量稀盐酸 | 有微量气泡,固体全部溶解,得到澄清溶液 |
| ② | 加入适量蒸馏水 | 固体部分溶解 |
| ③ | 加入适量无水乙醇 | 固体部分溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com