
| A. | 剩余固体为混合物 | |
| B. | 剩余固体中含有钙元素的质量为4.0g | |
| C. | 将剩余固体溶于足量水中,其溶质质量为7.6g | |
| D. | 将加热产生的气体全部通入足量澄清石灰水中,生成5.0g固体 |
分析 反应前后的固体质量差即为反应生成一氧化碳的质量,根据反应的化学方程式和提供的数据可以判断相关方面的问题.
解答 解:A、12.8gCaC2O4固体完全分解后得到碳酸钙质量是10g,一氧化碳质量是2.8g,剩余固体质量是10g,因此该反应是草酸钙完全分解后,碳酸钙分解生成了氧化钙和二氧化碳,反应生成二氧化碳质量为:12.8g-2.8g-5.6g=4.4g,则反应的碳酸钙质量是10g,因此反应后剩余固体是氧化钙,即剩余固体是纯净物,该选项说法不正确;
B、剩余固体中含有钙元素的质量为:5.6g×$\frac{40}{56}$×100%=4.0g,该选项说法正确;
C、氧化钙和水反应生成氢氧化钙的化学方程式及其质量关系为:
CaO+H2O═Ca(OH)2,
56 74
由以上质量关系可知,5.6g氧化钙溶于足量水中,其溶质质量为7.4g,该选项说法不正确;
D、氢氧化钙和二氧化碳反应的化学方程式及其质量关系为:
Ca(OH)2+CO2═CaCO3↓+H2O,
44 100
由以上质量关系可知,4.4g二氧化碳和足量氢氧化钙反应生成碳酸钙的质量是10.0g,该选项说法不正确.
故选:B.
点评 剩余固体中含有钙元素的质量也可以这样计算:12.8g×$\frac{40}{128}$×100%=4.0g,这是因为加热过程中钙元素没有流失,始终在剩余固体中.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 用如图所示装置分别进行以下实验.
用如图所示装置分别进行以下实验.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 苏打不仅常在做馒头面包中使用,实验室还可以用于检验SO42- | |
| B. | 浓硫酸具有吸水性,常用作食品干燥剂 | |
| C. | 食醋不仅是生活中的调味品,还可用于除水垢 | |
| D. | 氢氧化钠呈碱性,可用于治疗胃酸过多 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
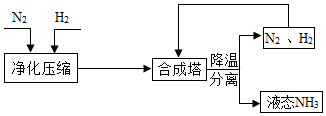 工业上合成 NH 3 的工艺流程可简化为:
工业上合成 NH 3 的工艺流程可简化为:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 向含有CuSO4和HCl的混合溶液中逐滴加入一定量的NaOH溶液,充分反应,生成沉淀的质量(m1)与加入NaOH溶液的质量(m2)的关系如图所示,回答下列问题:
向含有CuSO4和HCl的混合溶液中逐滴加入一定量的NaOH溶液,充分反应,生成沉淀的质量(m1)与加入NaOH溶液的质量(m2)的关系如图所示,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com