
【题目】水者,万物之本。
(1)水的保护
①保护水资源是每个公民应尽的责任和义务,下列的防止水污染的措施可行的是_________。
a.抑制水中所有动植物生长 b.不任意排放工业废水
c.禁止使用农药和化肥 d.生活污水处理后再排放
②我国研制出比漂白粉更高效的饮用水消毒剂ClO2,制取ClO2反应为::X+2NaClO2=2ClO2+2NaCl,则X的化学式为____________。
(2)水的组成写出电解水的化学方程式___________________________________________。
(3)水的用途
①将下列物质加入足量的水中,能形成无色溶液的是_________(填字母)。
a.植物油 b.蔗糖 c.碳酸钙 d.高锰酸钾
②农业生产中,用质量分数为7.1%的KNO3溶液作为无土栽培的营养液,欲配制100g该营养液,需水__________mL(水的密度近似看作1g/cm3)。
③KCl和KNO3溶解度曲线如图所示,30℃时取KNO320g,用50g水充分溶解,再将溶液降温到10℃,此时KNO3溶液的质量是____________。30℃时,KNO3饱和溶液的溶质质量分数与KCl饱和溶液的溶质质量分数相比,前者与后者的关系是_________(填字母)。
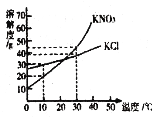
a.大于 b.小于 c.等于 d.无法确定
【答案】bd Cl2 2H2O![]() 2H2↑+O2↑ b 92.9mL 60g a
2H2↑+O2↑ b 92.9mL 60g a
【解析】
(1)①a、抑制水中所有动植物生长不是防止水污染的措施,选项a错误;
b、不任意排放工业废水能保护水资源,选项b正确;
c、不能禁止使用农药和化肥,选项c错误;
d、生活污水处理后再排放能保护水资源,选项d正确;
故填:bd;
②X+2NaClO2=2ClO2+2NaCl,反应前含有X,2gNa原子,2个Cl原子,4个O原子,反应后含有4个Cl原子,4个O原子,2个N原子,故X中含有2个Cl原子,其化学式为Cl2。
(2)电解水生成氢气和氧气,反应方程式为2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
(3)①a、植物油不溶于水,不能形成溶液,选项a错误;
b、蔗糖能溶于水形成无色溶液,选项b正确;
c、碳酸钙不能溶于水,不能形成溶液,选项c错误;
d、高锰酸钾能溶于水形成紫红色溶液,选项d错误;
故选b。
②溶液中含有溶质的质量为:100g×7.1%=7.1g,则水的质量为100g-7.1g=92.9g,即92.9mL;
③30℃时,取KNO320g,用50g水充分溶解,再将溶液降温到10℃,硝酸钾的溶解度为30g,只能溶解10g,此时KNO3溶液的质量是10g+50g=60g;30℃时,硝酸钾的溶解度大于氯化钾,故KNO3饱和溶液的溶质质量分数与KCl饱和溶液的溶质质量分数相比,硝酸钾的溶质质量分数大于氯化钾,故选a。


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:初中化学 来源: 题型:
【题目】图示中A~F是初中化学常见的物质,其中A是一种钠盐,C、D为氧化物,A、B、C、D、E中都含有氧元素,且物质C的固体俗称“干冰”。图中“—”表示相连的两种物质之间可以发生反应,“→”表示物质间存在着相应的转化关系(部分反应物、生成物及反应条件已略去)。
请分析后作答:
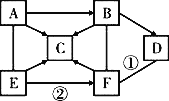
(1)物质C的化学式__________。
(2)反应①的基本反应类型是______________。
(3)反应②的化学方程式_______________________。
(4)写出B的一种用途_________________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A﹣J是初中化学常见物质,它们之间的转化关系如图所示(反应条件已略去)。其中G是大理石的主要成分,A为红棕色化合物,I为红色单质,B、D为组成元素相同的气体。
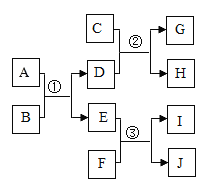
请回答下列问题:
(1)I的化学式为_____。
(2)反应①的反应化学方程式为_____。
(3)反应②的反应化学方程式为_____。
(4)反应③的基本反应类型为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小明对铁的锈蚀进行如下探究,室温时,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,装置如图,观察到量筒内水沿导管慢慢进入广口瓶(净容积为146mL)。当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零)。记录起始和最终量筒的读数以及所需时间如表。
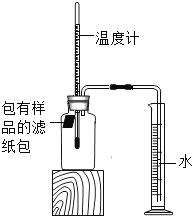
序号 | 样品 | 量筒起始 读数/mL | 量筒最终 读数/mL | 所需时间 /min |
1 | 1g铁粉、0.2g碳和10滴水 | 100 | 70 | 约120 |
2 | lg铁粉、0.2g碳、10滴水和少量NaCl | 100 | 70 | 约70 |
3 | …… | 100 | 70 | 约480 |
(1)实验①和②说明NaCl可以_____铁锈蚀的速率。
(2)实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是_____(填“放热”或“吸热”)过程。
(3)实验结束后取出滤纸包,观察到有红棕色物质生成,该物质的化学式是_____。
(4)已知含碳能够加快铁的生锈速度,小明想通过实验①和③是探究碳对铁锈蚀速率的影响,请在表格空白处填写实验③的样品组成_____。
(5)该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积含量是_____(小数点后保留1位)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某混合气体可能有CO2、CO、H2中的一种或几种,某学习小组的同学为了探究气体的组成,设计了如下装置进行实验(夹持装置已省略)。实验后发现A装置中 溶液变浑浊,C中的固体由黑色变红色,D中的固体由白色变蓝色,F装置中有水流入烧杯。在反应前后对C、D装置进行了质量的测量(各步反应均完全),测量结果如下表:
反应前后 | 反应前 | 反应后 |
C装置中的试管与固体的总质量(克) | a | c |
D装置的中U形管与固体的总质量 | b | d |
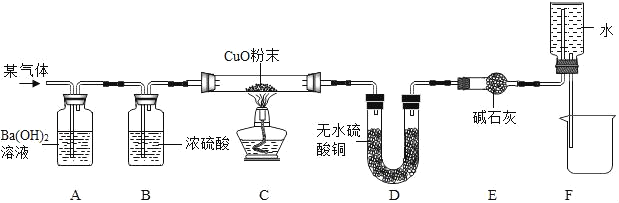
请分析回答下列问题;
(1)请写出A装置中反应的化学方程式_____。
(2)一定能证明原混合气体中有氢气存在的实验现象是_____。
(3)证明原混合气体中有CO存在的定量关系式是_____(用字母a、b、c、d表示)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某课外活动小组同学用图中装置(固定装置未画出)测定含有杂质的镁带中镁单质的质量分数(杂质与酸接触不产生气体)。实验过程如下:
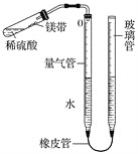
①取一段镁带样品,准确称得其质量为0.030 g;
②往量气管内装水至低于刻度“0”的位置,如图所示,(未装药品)装配好仪器;
③_________________________;
④在试管中加入足量的稀硫酸,稍倾斜试管,将用水湿润的镁带小心贴在试管壁上,塞紧橡皮塞;
⑤调整量气管液面,使两边的液面保持同一水平,记录量气管中液面位置;
⑥把试管底部略为抬高,使镁带与稀硫酸接触完全反应;
⑦待冷却至室温后,再次记录量气管中液面位置;
⑧算出量气管中增加的气体体积为23.96 mL;
已知:同温同压下,不同气体混合后体积等于混合前各气体体积之和。
请回答下列问题:
(1)写出镁与稀硫酸反应的化学方程式:____________________。
(2)能否用托盘天平称量0.030 g镁带样品________(填“能”或“不能”)。
(3)操作③是_________________________。
(4)实验过程⑦中再次记录量气管的液面位置时,试管中留有氢气,是否会影响实验最终结果________(填“是”或“否”),理由是_______________________。
(5)若实际测得氢气的体积与理论值相比偏大,则可能的原因是________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在高温下,铁与水蒸气能发生反应生成一种常见的铁的氧化物和一种气体.某兴趣小组请你参与研究:铁与水蒸气反应一段时间后剩余固体物质的成分、性质及再利用.
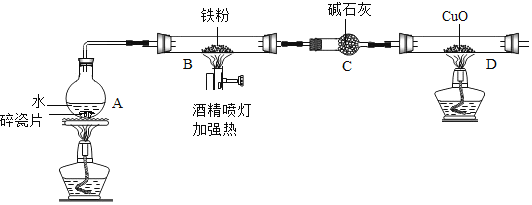
(1)(推断)观察到D中黑色固体变红,则B中生成的气体是______.
(2)探究B装置中剩余固体成分是什么?
(查阅资料)
(1)碎瓦片能防爆沸,碱石灰是氧化钙和氢氧化钠的混合物
(2)铁的氧化物中,只有Fe2O3是红棕色,其余均为黑色,只有Fe3O4能被磁铁吸引.
(3)Fe3O4+8HCl=FeCl2+2FeCl3+4H2O、Fe3O4+4H2SO4=FeSO4+Fe2(SO4)3+4H2O
(初步探究)B装置中剩余固体为黑色,能全部被磁铁吸引
(猜想与假设)
猜想一:剩余固体是Fe3O4
猜想二:剩余固体是______
(实验探究)
实验操作 | 实验现象及结论 |
______ | ______ |
(实验结论)铁与水蒸气反应的化学方程式为______.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图为a、b、c三种固体物质的溶解度曲线.下列说法中,正确的是( )
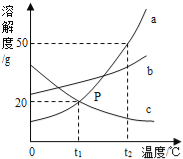
A. 将t2℃的a、b、c的饱和溶液降温到t1℃,溶液中溶质质量分数的关系是b>a=c
B. t1°C时,将20gc加入50g水中充分溶解,得到70克饱和溶液
C. t2°C时,a溶液的溶质质量分数一定大于b溶液的溶质质量分数
D. t1°C时,a、b、c的饱和溶液中,溶质质量分数最大的是b
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】由氯化钡废液(杂质为FeCl3及微量NaCl)制备产品BaC122H2O的流程如图。
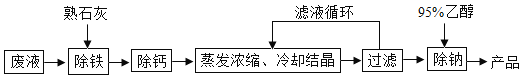
(1)氯化钡废液属于_____(填“纯净物”或“混合物”)。FeCl3中铁元素的化合价是_____。
(2)煅烧石灰石制取生石灰的化学方程式为_____,生石灰变成熟石灰的过程是_____过程(填“吸热”或“放热”),石灰水能使紫色石蕊试液变_____色。石灰石和熟石灰中常用于改良酸性土壤的是_____。
(3)用95%乙醇(C2H6O)洗涤滤渣可除微量NaCl.C2H6O由_____种元素组成,是_____化合物(填“有机”或“无机”)。C2H6O在O2中完全燃烧生成CO2和_____。2个CO2分子可用化学符号表示为_____。煤、氢气、乙醇三种燃料中,最清洁的是_____。
(4)结合流程和表回答:工业上选择25℃而不选择5℃进行冷却结晶的主要原因是①滤液多次循环后,25℃与5℃结晶产品的总产率基本相同;②_____。
表:每次结晶时,温度对产品纯度和产率的影响
冷却结晶的温度/℃ | 产品的纯度/% | 产品的产率/% |
5 | 99 | 72 |
25 | 99 | 60 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com