
【题目】钙元素对人类生命和生活具有重要意义,含钙的物质是中学化学研究的重要内容。
(1)牛奶中的钙主要以磷酸钙(Ca3(PO4)2 的形式存在,磷酸钙中磷元素的化合价为_____价。
(2)生石灰溶于水可制得熟石灰,该反应过程中能量的变化是_____(填“吸热”或“放热”)。
(3)氢化钙固体是登山运动员常用的能源提供剂某研究小组的同学通过查阅资料得知:氢化钙(CaH2)遇水反应生成氢氧化钙和氢气。该研究小组的同学把一定量的氢化钙加入到碳酸钠溶液中,充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。
(提出问题)滤液中溶质的成分是什么?
猜想一:氢氧化钠
猜想二:氢氧化钠、氢氧化钙
猜想三:氢氧化钠、碳酸钠
猜想四:氢氧化钠、碳酸钠、氢氧化钙
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明理由_____。
(实验验证)
实验 | 现象 | 结论 |
①取少量滤液,向其中滴加少量碳酸钠溶液 | 无明显现象 | 猜想_____不成立 |
②另取少量滤液,向其中滴加足量稀盐酸 | _____ | 猜想三成立 |
(反思与拓展)
①要证明猜想三成立,也可以另取少量滤液,向其中滴加_____。
②在分析化学反应后所得物质的成分时,除考虑生成物外还需考虑_____。
③登山运动员携带氢化钙作为能源提供剂与携带氢气相比,其优点是_____(写一条即可)。
【答案】+5 放热 ![]() 二 滤液中有气泡冒出 足量稀硫酸或足量稀硝酸或含
二 滤液中有气泡冒出 足量稀硫酸或足量稀硝酸或含![]() 或
或![]() 的溶液如氯化钙溶液、硝酸钡溶液等 反应物是否有剩余 携带方便等
的溶液如氯化钙溶液、硝酸钡溶液等 反应物是否有剩余 携带方便等
【解析】
化合物中元素化合价代数和为零;氧化钙和水反应生成氢氧化钙,放热;碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,和稀盐酸反应生成氯化钠、水和二氧化碳,和氯化钙反应生成碳酸钙沉淀和氯化钠;氢气难于压缩,和空气或要求混合达到爆炸极限时,加热或遇明火会发生爆炸。
(1)磷酸钙中钙元素化合价是+2,氧元素化合价是-2,根据化合物中元素化合价代数和为零可知,磷元素的化合价为+5价;
(2)生石灰溶于水可制得熟石灰,该反应过程中能量的变化是放热;
(3)[提出问题]经过讨论,大家一致认为猜想四不合理,这是因为氢氧化钙和碳酸钠不能共存,反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
[实验验证]①取少量滤液,向其中滴加少量碳酸钠溶液,无明显现象,说明溶液中不含有氢氧化钙;
②另取少量滤液,向其中滴加足量稀盐酸,产生气泡,是因为稀盐酸和碳酸钠反应生成了二氧化碳,说明溶液中含有碳酸钠;
[反思与拓展]①要证明猜想三成立,也可以另取少量滤液,向其中滴加氯化钙溶液,这是因为氯化钙能和碳酸钠反应生成白色沉淀碳酸钙和氯化钠;
②在分析化学反应后所得物质的成分时,除考虑生成物外还需考虑反应物是否过量;
③登山运动员携带氢化钙作为能源提供剂与携带氢气相比,其优点是安全、便于携带等。


科目:初中化学 来源: 题型:
【题目】空气质量与氮氧化物有着密切的关系。一氧化氮和二氧化氮是两种重要的氮氧化物。一氧化氮(化学式为NO)是一种无色气体,熔点-163.6℃,沸点151℃,密度比空气略大,微溶于水。NO不稳定,易于空气中氧气发生反应,生成红棕色有刺激性气味的二氧化氮(NO2)。实验室用铜与稀硝酸反应来制备NO.工业上可用氨气与氧气为原料,在加热和催化剂条件下制得一氧化氮。汽车尾气(含有CO与NO等物质)是城市空气的污染源,治理的方法之一是在汽车的排气管上装一个“催化转换器”,使CO与NO反应,生成两种可参与大气生态环境循环的无毒气体。NO被发现广泛分布于生物体内各组织中。1992年被美国Science杂志评选为“明星分子”。NO在心、脑血管调节等方面有着十分重要的生物学作用,是心脑血管的保护神。
依据文章内容,请回答下列问题:
(1)NO的物理性质______。
(2)NO在空气一种会转变成______。
(3)NO可用______法收集。
(4)治理NO的化学方程式为______。
(5)NO对人类有利的一面主要体现在______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图为实验室常用的一些实验装置
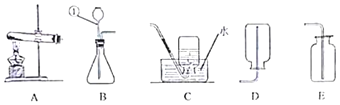
回答下列问题:
(1)写出带标号仪器①的名称:______;
(2)写出锌和稀硫酸反应的化学方程式:______;
(3)实验室收集CO2气体的装置是:______;
(4)通常状况下,NH3为无色、密度小于空气且极易溶于水的气体。实验室制取NH3的原理为:将氢氧化钙与氯化铵两种固体混合物进行加热生成物为:氯化钙、氨气和水,根据以上的信息,写出实验室制取氨气的化学方程式:______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学用语可准确、规范地表示微观粒子、物质及其变化,是学习和研究化学的重要工具。
(1)下列化学符号都存在书写错误,请予以改正。
①1个铁离子:![]() ________;②氧化锌中锌元素的化合价为+2价:
________;②氧化锌中锌元素的化合价为+2价:![]() ________。
________。
(2)请从氢氧化铝、甲烷、活性炭、纯碱中选择适当的物质填空(填化学式或主要成分的化学式)。
①____________可做冰箱除味剂;②________可用来治疗胃酸过多;
③________是天然气的主要成分;④________是玻璃、造纸等工业的重要原料。
(3)用化学方程式表示:工业上用熟石灰处理硫酸厂的废水________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属在生产、生活中有着广泛的应用。
(1)下列金属制品中,利用金属导电性的是_________(填序号)。

(2)工业上,用一氧化碳和赤铁矿(主要成分是Fe2O3)炼铁的化学方程式为_________,计算含氧化铁160t的赤铁矿,理论上能冶炼出纯铁的质量为_________t。
查看答案和解析>>
科目:初中化学 来源: 题型:
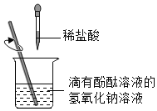
【题目】同学们为了探究盐酸和氢氧化钠是否发生反应,设计并进行了实验。
(1)小丽同学用如图进行实验,实验中观察到________现象能证明盐酸和氢氧化钠发生了化学反应,其理由是________。
(2)小明同学用pH传感器探究盐酸和氢氧化钠的反应。测定结果如图所示:
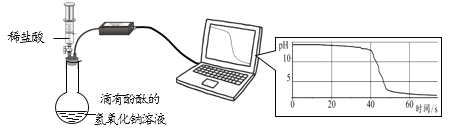
①盐酸和氢氧化钠反应的化学方程式为________。
②60 s时,烧瓶内溶液中的溶质有__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为探究盐酸的化学性质,某化学小组做了如下实验:
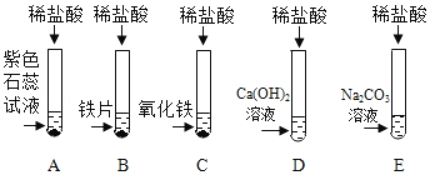
(1)A试管中的实验现象为_____,C试管中所发生反应的化学方程式为_____。
(2)将反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行探究。
(提出问题)滤液中溶质的成分是什么?
(作出猜想)猜想:NaCl
猜想二:NaCl和CaCl2
猜想三:_____
猜想四:NaCl、Ca(OH)2和HCl
(进行讨论)经过讨论,同学们一致认为猜想_____是错误的。
(设计实验)请完成实验报告。
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,滴加适量的碳酸钠溶液。 | _____ | 猜想二不成立 |
取少量滤液于试管中,滴加_____(填名称)。 | _____ | 猜想三成立 |
(迁移拓展)稀盐酸、稀硫酸有一些相似的化学性质,是因为在不同的酸溶液中都含有_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】推理是化学学习的常用方法。下列推理合理的是![]()
![]()
A. 离子是带电的粒子,所以带电的粒子一定是离子
B. 置换反应中有单质参与,但有单质参与的反应不一定都是置换反应
C. 生铁和钢都是铁合金,因此它们性能相同
D. 化合物是由不同元素组成的纯净物,但由不同元素组成的纯净物不一定是化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com