
【题目】某校社会大课堂活动组织同学们走进了污水处理厂。
(1)参观污水处理的第一道工序时,现场弥漫着难闻的气味,同学们不禁掩住口鼻。从微粒的角度说明能闻到气味的原因是_____________________。
(2)污水处理的第一道工序是经过如图所示的格栅,格栅是带有规则分布的方形网格,其作用是______________。

(3)二次沉淀池的主要作用是分离出活性污泥。活性污泥的作用是将污水中的一些有害物质经过生物降解转化为沼气(主要成分为CH4),沼气燃烧的化学反应方程式为_________。
科目:初中化学 来源: 题型:
【题目】下列图像分别与选项中的操作相对应,其中可能合理的是( )
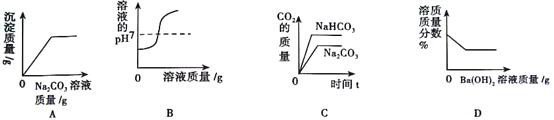
A. 向一定量的稀盐酸和CaCl2混合溶液中滴入Na2CO3溶液
B. 向一定量的氢氧化钠溶液中加入稀盐酸
C. 向等质量的Na2CO3和NaHCO3中加入足量的稀盐酸
D. 向一定量的稀硫酸中加入氢氧化钡溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】图1是甲、乙两种物质的溶解度曲线。20℃时,向两支试管中加入等质量的甲、乙两种固体物质,分别加入10g水,使其充分溶解,观察到图2所示的现象。下列说法正确的是
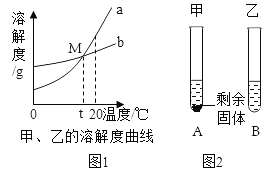
A. 20℃时,乙溶液是饱和溶液
B. t℃后某一温度时,乙溶解度大于甲的溶解度
C. 升高温度可使两试管中甲、乙溶液的质量分数均增大
D. 从20℃降低到t℃时,甲、乙两物质的溶解度相等,溶质质量分数甲溶液比乙溶液小
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如下图,是甲、乙两种固体物质的溶解度曲线,下列说法正确的是
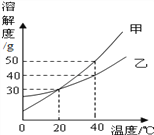
A. 甲的溶解度比乙大
B. 40℃时,甲的饱和溶液中溶质质量分数为50%
C. 40℃时,将50g乙物质全部溶于水中,恰好能得到150g乙的饱和溶液
D. 将130g 20℃甲的饱和溶液升温到40℃,最多还能溶解甲物质20g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氢化钙(CaH2)是一种常用的储氢材料,也是登山运动员常用的能源提供剂。
【资料在线】
Ⅰ.金属钙的活动性很强,遇水立刻剧烈反应生成氢氧化钙,同时产生一种气体。
Ⅱ.氢化钙要密封保存,一旦接触到水就发生反应,放出氢气。
Ⅲ.用氢气与金属钙加热的方法可制得氢化钙。
Ⅳ.白色的无水硫酸铜粉末吸水后会变蓝。
Ⅴ.碱石灰是固体氢氧化钠和氧化钙的混合物,碱石灰和无水氯化钙都可以吸收水分。
【探究一:定性分析】
(1)对于“金属钙与水反应生成的气体”有如下猜想: 甲:氧气,乙: 氢气
你支持________________(填“甲”、“乙”)观点,理由是__________________。
(2)CaH2中氢元素的化合价是____________,写出CaH2与水反应的化学方程式__________。
(3)实验室可用氢气与金属钙加热可得到氢化钙,以下是反应装置图。
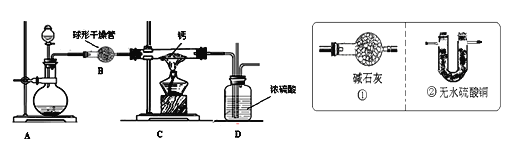
装置A是实验室制取氢气的装置,请写出其中反应的化学方程式______________, 装置B 中装有无水氯化钙,其作用是_______________________,若要证明进入C 装置中的氢气已经干燥,则应该在B、C之间连接右图中的哪个装置:____________(填①或②),现象是__________________。
(4)制备CaH2实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,向溶液中滴入酚酞后显红色。该同学据此判断:上述实验确实有CaH2生成。你认为该结论是否正确_____________(填“是”或“否”),原因是________________。
【探究二:产物定量测定】
﹙5﹚测定原理:根据金属钙、氢化钙都能与水反应生成气体的原理,采用测量气体的体积的方法,测定制得的氢化钙样品的纯度。甲、乙两位同学分别设计了如下两种方案。
甲方案:准确称量一定质量的氢化钙样品与水反应,利用下图装置测定生成的气体体积。为了比较准确的测量气体体积,在___________(填字母序号)进行收集。
A.气泡连续均匀时 B.刚开始有气泡时
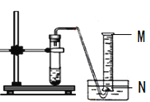
(6)规格为100mL量筒的最大刻度靠近____________端(填写“M”或“N”)。实验中100mL量筒中的水面下降到至45ml刻度时,收集到的气体体积为______________mL。
乙方案:准确称量一定质量的氢化钙样品与水反应,利用图2中的一种装置测定生成的气体体积。
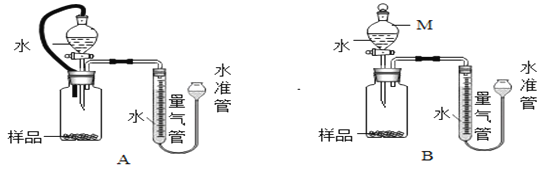
实验步骤如下:①连接装置并检查装置气密性;②准确称量所制得的氢化钙样品质量为46mg;③装药品,调节水准管至两边液面相平,读数;④打开分液漏斗活塞,加入足量的水;⑤冷却到室温;⑥调节水准管,至装置两边液面相平,读数、计算生成气体体积。
(7)相同条件下,使用_____________(填“装置A”或“装置B”)能使测定结果更准确。
(8)步骤⑥中调节液面相平的操作是将水准管______________(填“缓慢上移”或“缓慢下移”)。
(9)若称取所制得的氢化钙样品质量为46mg,步骤③中读数为10mL,反应结束后充分冷却,步骤⑥中读数为56.7mL。试通过计算求出∶
①样品中氢化钙的质量分数是___________。(该条件下氢气的密度为0.09mg/mL,计算结果保留一位小数)
②若其它操作均正确,仅因下列因素会使氢化钙的质量分数测定结果偏小的是_________(填字母序号)。
A.步骤④中加入的水量不足
B.步骤⑤中没有冷却至室温
C.步骤③中平视凹液面最低处,步骤⑥中仰视凹液面最低处
D.步骤⑥中没有调节水准管至两边液面相平,直接读数
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是关于氧气化学性质的部分知识网络:

(1)请写出乙醇燃烧的化学反应方程式______________________________。
(2)Ⅰ、Ⅱ两类反应均体现了氧气的化学性质_______________________。
(3)下图为生活中常见“暖贴”的部分标签。

暖贴中活性炭具有____________作用;暖贴发热其原理是利用铁与空气中某些物质发生缓慢氧化而产生的,请问空气中的这些物质是_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】1000 mL某饮用矿泉水的成分如图所示。

(1)此矿泉水中至少含有________种元素。
(2)在H2SiO3中,氢、氧原子的个数比为___________。
(3)在H2SiO3中,硅元素质量分数的计算式为_____________。
(4)某同学喝了500 mL该矿泉水,他摄入钾元素的质量为________mg。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A-H是初中化学常见的物质,A和C的组成元素相同、在常温下均为液体,B为单质,D为常见的碱,E为一种常见的建筑材料,它们的相互转化关系如图所示(反应条件、部分生成物己略去)。

(1)G的化学式为_________
(2)反应③的化学方程式为__________________________
(3)反应④的基本反应类型_______________
(4)反应⑤在实际中的应用是_____________________________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组用数字化传感器探究稀NaOH溶液与稀盐酸反应过程中温度和pH的变化,测定结果如下图A、B图所示。
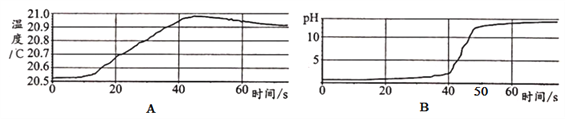
(1)图A表明该反应_____(选填“吸热”或“放热”)。
(2)图B表明实验时是将_____(选填“稀盐酸滴入氢氧化钠溶液”或“氢氧化钠滴入稀盐酸”)中。
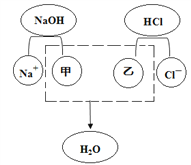
(3)酸与碱发生中和反应的结果是酸和碱各自的特性都消失。下图是氢氧化钠与盐酸反应的微观实质,请从微观的角度分析甲、乙处分别应填入的符号为_____、_____。
(4)做完氢氧化钠与稀盐酸反应的实验后,该小组的同学对反应后溶液中是否有稀盐酸剩余提出如下方案:
a:取样,滴加石蕊试液,若变_____,证明有盐酸剩余。
b:取样,加入一小块石灰石,若观察到_____,证明有盐酸剩余。发生反应的化学方程式为_____。
c:取样,滴加硝酸银溶液,若观察到有白色沉淀,证明有盐酸剩余。同学们认为该方案不合理,理由是_____(用化学方程式表示)。
(5)若将20.0g稀盐酸滴加到10.0%的氢氧化钠溶液16.0g(含2滴酚酞试液)中,充分反应后溶液刚好变为无色,可视为恰好完全反应。则反应后所得NaCl溶液的溶质质量分数为多少?(写出计算过程)______________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com