
【题目】鸡蛋壳的主要成分是碳酸钙,某兴趣小组为了测定某鸡蛋壳中CaCO3的含量,现取15g鸡蛋壳,捣碎,放在烧杯里,然后向其加入80g某浓度的稀盐酸,使之充分反应后,(鸡蛋壳中除CaCO3外的其他成分都不溶于水,不与稀盐酸反应),测得烧杯中的反应剩余物的质量(m)与反应时间(t)的关系如图所示(忽略水蒸气的挥发)其中当反应进行到B点时,所用盐酸刚好消耗了加入量的一半,试计算:
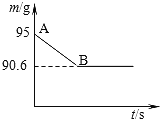
(1)产生CO2的质量为_______g:
(2)计算该鸡蛋壳中CaCO3的质量分数;____________
(3)所用稀盐酸中溶质的质量分数。______________
 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:初中化学 来源: 题型:
【题目】某氯化钙样品中可能混有氯化铁、氯化镁、氯化钠、碳酸钠中的一种或几种物质.取该样品11.1g溶于适量水中,得到澄清的无色溶液,然后向其中加入足量的硝酸银溶液,得到29.7g白色沉淀,则该样品组分的下列推断中,正确的是
A. 既无氯化铁,也无碳酸钠B. 只有氯化镁,没有氯化钠
C. 肯定有氯化镁,可能有氯化钠D. 肯定有氯化镁,也肯定有氯化钠
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】李小龙,祖籍广东佛山市顺德区均安镇,不仅是享誉海内外的功夫巨星也是一位武术哲学家。其创立的截拳道,体现了融合生成的方法论思想。在化学学习过程中,老师设计了如图的“功夫小子”游戏,图中A B C D E F G H分别是氢气、稀盐酸、铁粉、氧化铜、碳酸钡、二氧化碳、澄清石灰水、纯碱溶液中的一种,游戏规则:①要求相连的两种物质能发生化学反应,且E与F不反应,G与H不反应;②B与D的物质类别相同;③物质不能重复。请你参加完成游戏,并回答下列问题:
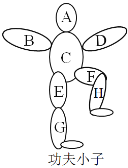
(1)找出图中物质的化学式:A:_____;D:_____。
(2)已知B能与F反应,该反应的化学方程式为_____,该反应常用来_____。
(3)E→H的反应基本类型与E和G的反应类型相同,写出E→H的化学方程式:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】试管中分别盛装甲、乙的饱和溶液,向烧杯中加入一定量NaOH固体后,A试管中变浑浊,结合图象,下列说法正确的是( )
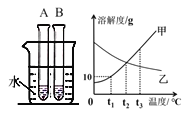
A. A试管中是甲溶液
B. t1℃时,甲的饱和溶液溶质质量分数为10%
C. 将t3℃时甲、乙饱和溶液降温至t2℃,溶质的质量分数甲=乙
D. t3℃时,等质量的甲、乙饱和溶液中,溶剂质量甲<乙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】20℃时,将等质量的a、b两种固体,分别加入到盛有lO0g水的烧杯中,充分搅拌后现象如图甲,升温到50℃时,现象如图乙,a、b两种固体的溶解度曲线如图丙。下列说法正确的是
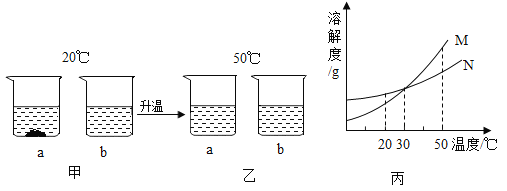
A.图丙中M表示b的溶解度曲线
B.图甲溶液中溶质的质量分数a大于b
C.图乙中a、b溶液一定是不饱和溶液
D.30℃时a、b溶液溶质质量分数不相等
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“氧泡泡”系列产品去污能力强、绿色环保,已成为中国氧系清洁品种领导品牌,其主要成分是过碳酸钠(2Na2CO3·3H2O2),为了方便保存,过碳酸钠样品可能添加少量的MgSO4和硅酸镁中的一种或二种作为稳定剂(硅酸镁不溶于水)。某化学课外兴趣小组对过碳酸钠产生了浓厚的兴趣,决定对其进行探究。
(查阅资料)Ⅰ.过碳酸钠在水中易离解成Na2CO3和H2O2,其水溶液具有Na2CO3和H2O2的双重性质;双氧水可用于供氧、消毒和漂白
Ⅱ.过碳酸钠能与盐酸反应:2(2Na2CO3·3H2O2)+8HCl=8NaCl+4CO2↑+3O2↑+10H2O
Ⅲ.过碳酸钠的去污能力主要与其在反应中释放出的“活性氧”有关,“活性氧”含量越高,去污能力越强。
(分析推理)(1)Na2CO3中碳元素的化合价是_____。
(2)根据资料可知:过碳酸钠的用途不合理的是_____。
A 鱼池供氧剂B 消毒剂C 干燥剂D 漂白剂
(3)取少量过碳酸钠样品于烧杯中,加入足量蒸馏水,有不溶于水的固体产生。判断样品中_____有硅酸镁。(填写“可能”或“一定”)
(4)向过碳酸钠水溶液中加入少量MnO2时产生大量气泡,发生反应的化学方程式是_____。
(实验探究)过碳酸钠样品中“活性氧”含量可按如下公式计算:
“活性氧”含量=![]() ×100%
×100%
(5)为测定某过碳酸钠样品中“活性氧”含量,取20.0g样品按下图实验装置与足量盐酸反应。(已知样品中杂质不溶于水且不与酸反应,装置气密性良好)
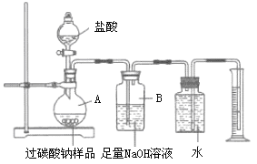
①将盐酸慢慢滴入A中,反应一段时间,观察到_____,停止滴加盐酸。
②装置B可吸收生成的CO2,该反应的化学方程式是_____。
③甲同学认为若要得出生成氧气的质量,除要记录量筒内液体的读数外,还需要知道的数据是该实验条件下的_____。
(总结计算)(6)将反应后A中所得溶液过滤、蒸发、结晶、烘干,称得固体质量为11.7g,乙同学据此计算出该过碳酸钠样品的“活性氧”含量_____,写出其计算过程。
(拓展延伸)(7)完成上述探究后,丙同学提出:称量反应前后装置B的质量,其质量差就是反应生成CO2的质量,据此可计算出样品中“活性氧”含量。但丁同学认为该方案不合理,丁同学的理由是_____。
A 盐酸挥发出的HCl进入B装置中 B 催化剂没有让过氧化氢完全反应
C 有部分二氧化碳溶于A装置中 D 装置中还有部分残留的二氧化碳
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】过氧化镁(MgO2)是一种镁精细化工产品。在医疗上可用来治疗消化不良、胃酸过多等疾病。在环境保护方面,过氧化镁可用来处理地下水污染的土壤。还可以用于牙膏,对牙齿有漂白和防过敏的作用。某化学兴趣小组对过氧化镁的性质和制备等进行了以下研究。
一.过氧化镁的性质
(1)过氧化镁(其中氧元素的化合价为____)是一种白色的粉末,其外观与物理性质与氧化镁相似。化学性质不够稳定,不溶于水,但逐渐的被分解放出氧气。
过氧化镁有强氧化性,常温下比较稳定,但是加热时会分解生成氧气和氧化镁。请下出该反应的化学方程式________。
(2)过氧化镁易溶于稀盐酸,发生反应:MgO2+2HCl=MgCl2+H2O2同时温度升高,说明该反应热量__________(填“放出”或“吸收”)。
二.过氧化镁的制备
下图是利用碱式碳酸镁(Mg2(OH)2CO3)和30%的过氧化氢溶液来制取过氧化镁。
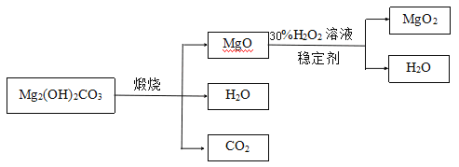
(资料)①碱式碳酸镁与碳酸镁有相似的化学性质,能与稀盐酸反应产生二氧化碳②氧化镁与过氧化氢反应放出大量的热
(3)检测煅烧过程碱式碳酸镁完全分解的方法是_________(写出具体的操作和现象);上述生产过程加入稳定的剂的作用是________。
(4)用上述碱式碳酸镁在550、600、650及700℃下煅烧一定的时间生成氧化镁。用上述条件制备的氧化镁分别与30%双氧水反应合成过氧化镁产率(见图1和图2)。
碱式碳酸镁煅烧的温度适宜控制在________℃,煅烧的时间适宜控制在______h。
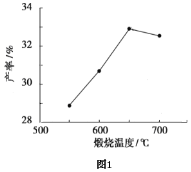
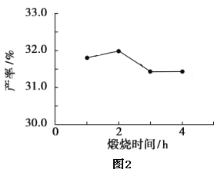
(5)结果在适宜的温度和时间下,碱式碳酸镁能完全分解,并且得到的氧化镁颗粒表面积最大,能与30%过氧化氢充分反应,所以产率高。推测700℃时,产率明显降低的可能的原因____。
三.过氧化镁产品纯度检测
在生产过程中,过氧化镁中常常含有少量的氧化镁杂质(其他杂质不考虑),以下是该小组进行纯度检测的实验装置和实验步骤。

①检查装置气密性,装入药品(样品质量为0.7g),调节刻度管使左右两边液面相平,刻度管度数为10.0mL。
②打开分液漏斗开关,待瓶中无气泡产生时,关闭开关。
③再次调节刻度管使左右两边液面相平,刻度管度数为122mL。
(6)稀盐酸中放入的少量硫酸铜溶液目的是__________。
(7)根据上面实验数据计算样品中过氧化镁的质量分数__________(写出具体的计算过程,实验条件下O2密度为1.429g/L)。
(8)该小组同学所测得质量分数比实际结果偏大,你觉得可能的原因是(_______)
A 生成的氧气有少量溶于水 B 未等装置冷却到室温就开始读数
C 杂质与盐酸反应能产生少量的气体 D 滴入的稀盐酸占了一部分气体的体积
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在加热的条件下,Cu(NO3)2可分解为CuO、O2和某种氮的氧化物X,取一定质量的Cu(NO3)2固体充分加热,测得反应后生成CuO、O2、X的质量分别是8g、mg、9.2g。下列说法正确的是
A. m的值为1.6g
B. 氮的氧化物X的化学式是NO
C. 该反应方程式中,CuO和O2的化学计量数之比为3:2
D. 该反应只有一种元素化合价发生改变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为除去粗盐水中的可溶性杂质MgSO4、CaCl2,某化学小组设计了如图方案:
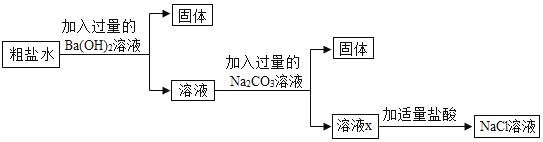
(1)加入Ba(OH)2溶液后过滤,固体的成分有_____。(写化学式)
(2)写出一个加入Na2CO3后发生反应的化学方程式_____。(写一个即可)
(3)溶液X中含有哪些物质?请设计实验证明溶液X中的杂质_____。(简要写出实验步骤和现象)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com