
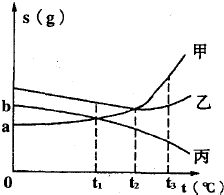
 如图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线,将t3℃时甲乙丙三种物质的饱和溶液进行以下操作,下列说法正确的是
如图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线,将t3℃时甲乙丙三种物质的饱和溶液进行以下操作,下列说法正确的是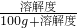 ×100%,比较三种物质的饱和溶液降温所得溶液的溶质质量分数的大小;
×100%,比较三种物质的饱和溶液降温所得溶液的溶质质量分数的大小;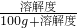 ×100%,可知降温到t2℃,所得溶液中溶质质量分数大小顺序为乙═甲>丙;故③说法正确;
×100%,可知降温到t2℃,所得溶液中溶质质量分数大小顺序为乙═甲>丙;故③说法正确;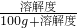 ×100%,可知降温到t2℃,所得溶液中溶质质量分数大小顺序为乙═甲>丙;故④不正确;
×100%,可知降温到t2℃,所得溶液中溶质质量分数大小顺序为乙═甲>丙;故④不正确;

 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:


查看答案和解析>>
科目:初中化学 来源: 题型:
 如图是甲、乙、丙三种固体(均不含结晶水)的溶解度曲线.20℃时,烧杯中分别盛有相同质量的甲、乙、丙饱和溶液,各加入等质量的对应固体,并升温至40℃,观察到,甲固体逐渐减少至全部溶解,下列判断正确的是( )
如图是甲、乙、丙三种固体(均不含结晶水)的溶解度曲线.20℃时,烧杯中分别盛有相同质量的甲、乙、丙饱和溶液,各加入等质量的对应固体,并升温至40℃,观察到,甲固体逐渐减少至全部溶解,下列判断正确的是( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com