
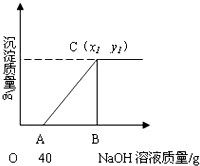
 有盐酸和CuCl2的混合溶液共100g,向混合溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成的沉淀与加入的10%的NaOH溶液质量关系如图所示.若CuCl2在混合溶液中质量分数为13.5%.求:
有盐酸和CuCl2的混合溶液共100g,向混合溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成的沉淀与加入的10%的NaOH溶液质量关系如图所示.若CuCl2在混合溶液中质量分数为13.5%.求:分析 (1)CuCl2和HCl的混合溶液中,逐滴加入NaOH溶液,氯化氢先与氢氧化钠反应生成氯化钠和水,然后氯化铜再与氢氧化钠反应生成氢氧化铜沉淀和氯化钠,化学方程式分别为:NaOH+HCl═NaCl+H2O;CuCl2+2NaOH═Cu(OH)2↓+2NaCl,由题目中图可以看出:和稀盐酸反应的氢氧化钠溶液的质量为40g,已知氢氧化钠溶液的质量分数为10%,可根据参加反应的氢氧化钠的质量求出溶液中HCl的质量分数;
(2)由题目中图可以看出:C点的横坐标的值为完全反应后生成沉淀的质量,纵坐标的值为参加反应的氢氧化钠溶液的总质量;由于题目中指出:CuCl2在混合溶液中质量分数为13.5%,故可求出参加反应的氯化铜的质量为:100g×13.5%=13.5g,可根据氯化铜的质量求出与氯化铜反应的氢氧化钠溶液的质量及生成沉淀的质量,从而求出C点的坐标.
(3)分析题意可知,反应至C点时溶液中溶质为氯化钠,分析题意可知,反应至C点时溶液中溶质为氯化钠,根据氢氧化钠、氯化镁与盐酸反应的化学方程式,列出比例式,计算出生成氯化钠的质量,然后计算即可;
解答 解:CuCl2和HCl的混合溶液中,逐滴加入NaOH溶液,氯化氢先与氢氧化钠反应生成氯化钠和水,然后氯化铜再与氢氧化钠反应生成氢氧化铜沉淀和氯化钠,化学方程式分别为:NaOH+HCl═NaCl+H2O;CuCl2+2NaOH═Cu(OH)2↓+2NaCl,由题目中图可以看出:和稀盐酸反应的氢氧化钠溶液的质量为40g.(1)设该混合溶液中含HCl的质量为x.生成氯化钠的质量为r
HCl+NaOH═NaCl+H2O
36.5 40 58.5
x 40g×10% r
$\frac{36.5}{x}=\frac{40}{40g×10%}$,$\frac{40}{4g}=\frac{58.5}{r}$
x=3.65 g. r=5.85g
混合溶液中HCl的质量分数$\frac{3.65g}{100g}$×100%=3.65%
答:原混合溶液中HCl的质量分数为3.65%.
(2)氯化铜的质量为100g×13.5%=13.5g.
设与氯化铜反应的NaOH溶液的质量为y,生成Cu( OH)2的质量为z.生成氯化钠的质量为w
CuCl2+2NaOH═Cu(OH)2↓+2NaCl
135 80 98 117
13.5g 10%y z w
$\frac{135}{13.5g}=\frac{80}{10%y}$,$\frac{135}{13.5g}=\frac{98}{z}$,$\frac{135}{13.5g}=\frac{117}{w}$
解之得:y=80g;z=9.8g,w=11.7g
故:共滴入NaOH溶液质量为40 g+80g=120g,所以B点的值为120,即x1为120;
完全反应时产生Cu(OH)2质量为9.8g,即y1为9.8;
由题意可知C点横坐标的值为120,纵坐标的值为9.8,所以C 点坐标为(120,9.8).
答:C 点坐标为(120,9.8).
(3)则反应至C点时溶液中溶质的质量分数为:$\frac{5.85g+11.7g}{100g+120g-9.8g}$×100%=8.3%
答:恰好完全反应后经过滤所得滤液的溶质质量分数是8.3%.
点评 溶液和化学反应融合的题目,是综合性的题型,要求比较高.通常学生在计算时常常会忽视了实际参加反应的是溶液中溶质的质量,而往往会把40g直接代入化学方程式进行计算.这就要求学生足够细心、会分析、且条理分明.


科目:初中化学 来源: 题型:填空题
 化学实验是学习化学的基础,请根据如图回答问题:
化学实验是学习化学的基础,请根据如图回答问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 规范的实验操作是实验成功的前提,请回答:
规范的实验操作是实验成功的前提,请回答:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铁丝 | B. | 红磷 | C. | 碳粉 | D. | 硫磺 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
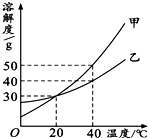
| A. | 40℃时,分别在100 g水中加入40 g 甲、乙,所得溶液溶质的质量分数相等 | |
| B. | 20℃时,甲、乙两物质的饱和溶液中溶质的质量分数相等 | |
| C. | 40℃时,将等质量的甲、乙两物质的饱和溶液,分别降温至 20℃,甲析出的晶体比乙多 | |
| D. | 20℃时,甲、乙的溶解度都是30 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 事实 | 解释 | |
| A | 一氧化碳有毒性 | 一氧化碳分子有毒 |
| B | 钛合金可用来制人造骨骼 | 钛合金与人体有很好的相容性 |
| C | 水银体温计测量高烧病人的体温 | 原子间间隔受热时增大 |
| D | 金刚石、石墨的物理性质存在很大差异 | 碳原子的结构不同 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
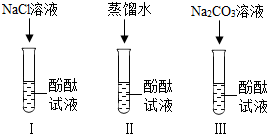 小宁和小明同学学习完酸、碱、盐后发现:碱溶液能使酚酞试液变红,Na2CO3溶液也能使酚酞试液变红.碱溶液使酚酞试液变红,是因为碱在水中解离出OH-,那么Na2CO3溶液中究竟是哪种粒子使酚酞试液变红呢?小宁设计了如图三个实验,请你、小宁和小明一起探究并完成下列问题:
小宁和小明同学学习完酸、碱、盐后发现:碱溶液能使酚酞试液变红,Na2CO3溶液也能使酚酞试液变红.碱溶液使酚酞试液变红,是因为碱在水中解离出OH-,那么Na2CO3溶液中究竟是哪种粒子使酚酞试液变红呢?小宁设计了如图三个实验,请你、小宁和小明一起探究并完成下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com