
【题目】某物质在点燃的条件下发生反应,生成物和反应物共四种,它们的微观示意图和反应前后的质量如表所示。
物质序号 | 甲 | 乙 | 丙 | 丁 |
|
微观示意图 |
|
|
|
| |
反应前质量/g | 68 | 100 | 1 | 0 | |
反应后质量/g | 0 | x | y | z |
(1)由![]() 构成的物质中
构成的物质中![]() 所代表的元素的化合价为_____;
所代表的元素的化合价为_____;
(2)表中的四种物质中,属于氧化物的是_____(填化学式);
(3)上述反应的化学方程式为_______________________。
【答案】-2 H2O、SO2 2H2S+3O2![]() 2SO2+2H2O
2SO2+2H2O
【解析】
分析微观示意图可知,甲是硫化氢,乙是氧气,丙是水,丁是二氧化硫。由题目已知某物质在点燃的条件下发生反应,则反应物有两种,氧气一定是反应物,硫化氢反应后质量为0,硫化氢也是反应物。生成物和反应物共四种,那么生成物有两种,分别是水和二氧化硫。该反应的化学方程式为2H2S+3O2![]() 2SO2+2H2O。
2SO2+2H2O。
(1)由![]() 构成的物质是硫化氢,在硫化氢中氢元素的化合价为+1价,根据正负化合价代数和为0,则硫化氢中硫元素的化合价为-2价;
构成的物质是硫化氢,在硫化氢中氢元素的化合价为+1价,根据正负化合价代数和为0,则硫化氢中硫元素的化合价为-2价;
(2)氧化物是由氧元素和另一种元素组成的化合物。该反应的四种物质中,属于氧化物的是H2O、SO2;
(3)由分析可知,该反应的化学方程式为:2H2S+3O2![]() 2SO2+2H2O。
2SO2+2H2O。


科目:初中化学 来源: 题型:
【题目】建造“南昌舰”的特种钢材需要用富铁矿石(含铁量高于50%)来冶炼。研学实践小组为测出某地赤铁矿石(主要成分是Fe2O3)中的含铁量,进行实验;取20g赤铁矿石样品,逐渐加入稀盐酸,充分反应。实验相关数据如图所示(假设杂质不溶于水,也不与酸反应)。
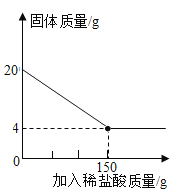
(1)20g赤铁矿石样品中氧化铁的质量为_______g;
(3)该样品中铁元素的质量分数为_______,由此判断出该赤铁矿石______(填“属于”或“不属于”)富铁矿石。
(4)计算试验中所用稀盐酸溶质的质量分数______(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】图所示实验中得出的结论不正确的是( )

A.甲实验:反应后天平指针偏右,是由于生成的气体逸出到空气了,该反应遵守质量守恒定律
B.乙实验:通过检验正极产生氧气,负极产生氢气,说明水是由氢、氧两种元素组成的
C.丙实验:同一瓶子放法不同,海绵凹陷程度不同,说明压力的作用效果与受力面积有关
D.丁实验:闭合开关后,导体ab自动向左或右摆动,说明导体在磁场中受到力的作用
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】溶液与人们的生产、生活密切相关。
图1为甲、乙两种固体物质的溶解度曲线。
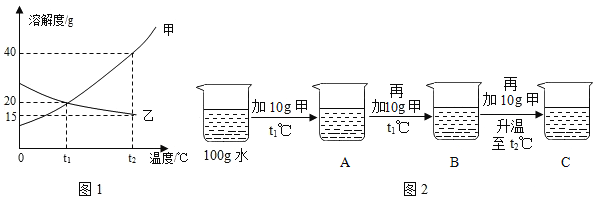
(1)溶解度随温度升高而增大的物质是_____ (填“甲”或“乙”)。
(2)某同学按图2所示进行实验,得到相应温度下的A、B、C三种溶液,在A、B、C三种溶液中属于饱和溶液的是_____(填字母)。 向C中再加入25g 甲,充分搅拌,恢复到t2℃时,所得溶液中溶质的质量分数为_____(结果精确到0.1%)。
(3)将t2℃时的甲、乙两种物质的饱和溶液降温至t1℃,所得溶液中溶质的质量分数:甲_____乙(填“<”“=”或“>”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列四个图象分别对应四种操作(或治疗)过程,其中正确的是( )
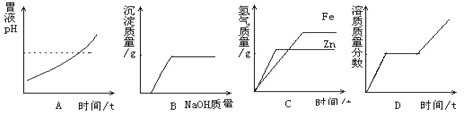
A. 用胃舒平[主要成分Al(OH)3]治疗胃酸过多时pH情况
B. 向氯化铁的溶液中加入氢氧化钠溶液直至过量
C. 常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应
D. 将一定质量的硝酸钾不饱和溶液恒温蒸发水分,直到有晶体析出
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列有关粒子结构示意图的说法正确的是( )
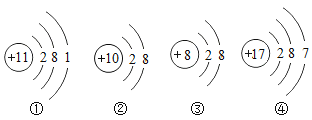
A.1个④粒子易失去最外层电子达到相对稳定结构
B.①和③可以形成化合物
C.②和③属于同一周期元素的不同粒子
D.②和③化学性质相似
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】分类、类比是学习化学常用的方法。
(1)初中化学有一些化学实验会产生空气污染物,为减少室内空气污染物,有的实验需要在通风橱中进行,有的根据实验需要在密闭装置中进行等。按照将空气污染物减少不同的方法,将下列实验进行分类,选择一组分类的序号,并说明分类依据。
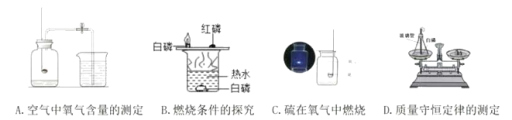
A空气中氧气含量的测定
B燃烧条件的探究
C硫在氧气中燃烧
D质量守恒定律的测定
你选择的实验_____(填字母),选择的依据_____。
(2)课外阅读发现:Fe3O4的化学式可看作:FeO﹒Fe2O3,Ca10(PO4)6(OH)2的化学可看作是Ca(OH)2﹒3Ca3(PO4)2,同理,Cu2(OH)2CO3,的化学式可看作_____;请写出Fe3O4与盐酸反应的化学方程式_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种固体物质(均不含结晶水)的溶解度曲线如图所示,下列说法错误的是( )
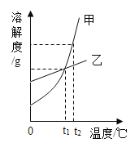
A.t2℃时,甲的饱和溶液比乙溶液的溶质质量分数大
B.t1℃时,向 50g水中加入 20g乙恰好达到饱和,则甲在该温度下的溶解度为 40g
C.甲中混有少量乙时,可用降温结晶的方法提纯甲
D.t2℃时,将等质量的甲、乙两种溶液分别降温到 0℃,甲、乙溶液均有晶体析出
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】学习兴趣小组对贝壳中碳酸钙的含量进行探究。
(提出问题)如何选择药品和设计装置进行测定?
(查阅资料)贝壳的主要成分是CaCO3,其它成分对实验影响忽略不计室温时,CaCO3不溶于水,CaSO4微溶于水
(设计与实验)实验一:选择药品。分别取等质量颗粒状和粉末状的贝壳样品与等体积、等浓度的稀盐酸在图1的三颈烧瓶中反应,采集数据
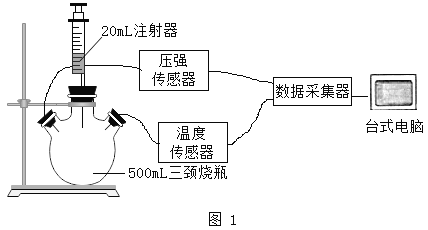

(1)图1中反应的化学方程式是_________
(2)据图2分析,选择粉末状样品的依据是________
(3)据图3分析,影响实验测定准确性的原因:一是水蒸气含量增加;二是_____
实验二:设计装置。小组设计了图4装置进行测定
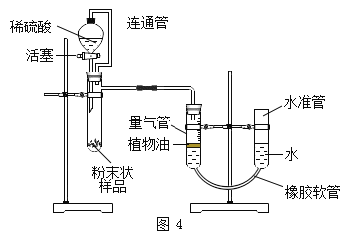
(4)打开活塞,稀硫酸进入试管,观察到的现象是_________。 反应结束后进行读数。读数前调节水准管与量气管液面相平的原因是_____
实验三:优化装置。在老师指导下,小组优化并设计了图5装置进行测定
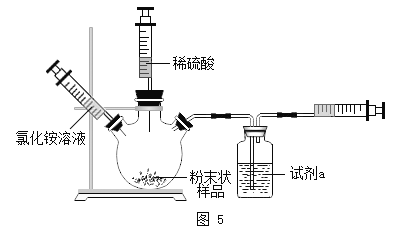
(5)试剂a是__________
(6)检查该装置气密性的方法是________
(7)加入足量稀硫酸,一段时间后反应停止。再加入氯化铵溶液,发现又产生气泡,推测加入氯化铵的作用是__________
(数据处理)
(8)实验三中,样品质量为m g,加入稀硫酸体积为V1mL,加入氯化铵溶液体积为V2 mL,右侧针筒最后读数为V mL,则反应生成CO2体积为______。该实验条件下CO2密度为d g/mL,则样品碳酸钙质量分数表达式为________
(反思与评价)
(9)与实验二相比,实验三的优点是______(写一点)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com