
用氢气还原氧化铜的方法测定某氧化铜样品的纯度(杂质不与氢气反应),同学们设计了以下实验装置,准确称取15克干燥样品进行实验.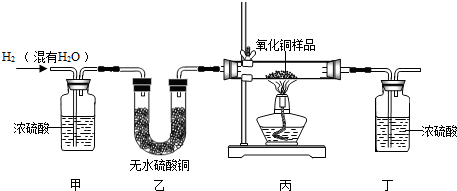
【查阅资料】①无水硫酸铜为白色固体,遇水变成蓝色。
②浓硫酸具有吸水性,可做干燥剂。
请根据资料回答:
(1)在实验中,乙装置的作用是 .
(2)准确称取完全反应前后装置丙和丁的质量如表:
| | 装置丙 | 装置丁 |
| 反应前 | 48.8克 | 161.2克 |
| 反应后 | 46.5克 | 163.9克 |
(1)检验氢气中水分是否全部被吸收 (2)80% (3) B
解析试题分析:(1)根据图示分析,氢气通过浓硫酸,是为了除去氢气中的水分,而无水硫酸铜遇到水会由白色变蓝色,所以再通过无水硫酸铜就是检验浓硫酸是否把氢气中的水分完全除尽。
(2)由于浓硫酸具有吸水性,故丁中浓硫酸质量的增加量就是反应生成的水的质量,再根据水的质量,利用反应的方程式中水与氧化铜的质量比,计算出氧化铜的质量,最后计算纯度即可。
解:根据浓硫酸质量的增加量就是生成的水的质量可知,生成水的质量=163.9g-161.2g=2.7g。
设要生成2.7g水需要参加反应的氧化铜的质量为X。
H2 + CuO Cu + H2O
Cu + H2O
80 18
X 2.7g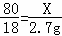
解得X=12g
则氧化铜的质量分数=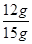 ×100%="80%"
×100%="80%"
(3)根据题意,小丽根据装置丁的质量变化进行计算的结果偏大,说明丁装置中吸收的水的量偏大,故其原因是由于浓硫酸与空气相通,吸收了空气中的水分而变大。故选B
考点:根据化学反应方程式的计算
点评:本题主要是利用图表及反应方程式来分析和解决化学计算中的有关问题,要求学生有较强的数据分析能力;解题的关键是要明确浓硫酸的增加量即为反应生成水的质量,然后根据相关的化学反应方程式,并依据已知量对未知的应求量进行求解计算即可,注意解题要规范;此外,最后的问题探究,要考虑浓硫酸的吸水性,不仅吸收了生成的水,而且吸收了空气中的水。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:初中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 | 结论和化学方程式 |
| 亮亮同学取少量黑色固体,放入试管中,加入足量的稀硫酸,微热. | 黑色固体完全消失,溶液变 蓝 蓝 色. |
此黑色固体是氧化铜.该反应的化学方程式为 CuO+H2SO4═CuSO4+H2O CuO+H2SO4═CuSO4+H2O |
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:020
下列反应属于置换反应的是
[ ]
A.实验室用锌粒和稀硫酸制氢气
B.实验室用加热高锰酸钾的方法制氧气
C.蜡烛在空气中燃烧
D.在加热条件下用氢气还原氧化铜
查看答案和解析>>
科目:初中化学 来源:2011年山东省淄博市高青县中考化学模拟试卷(解析版) 题型:解答题
| 实验步骤 | 实验现象 | 结论和化学方程式 |
| 亮亮同学取少量黑色固体,放入试管中,加入足量的稀硫酸,微热. | 黑色固体完全消失,溶液变______色. | 此黑色固体是氧化铜.该反应的化学方程式为______ |
查看答案和解析>>
科目:初中化学 来源:2011年山东省烟台市招远市中考化学模拟试卷(解析版) 题型:解答题
| 实验步骤 | 实验现象 | 结论和化学方程式 |
| 亮亮同学取少量黑色固体,放入试管中,加入足量的稀硫酸,微热. | 黑色固体完全消失,溶液变______色. | 此黑色固体是氧化铜.该反应的化学方程式为______ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com