
| A. |  吸取液体药品 | B. |  加热液体药品 | C. |  氧气的验满 | D. |  熄灭酒精灯 |
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 在点燃的条件下,硫在氧气里燃烧,发出蓝紫色火焰,生成有刺激性气味的气体 | |
| B. | 铝丝插入硫酸铜溶液中,铝丝表面有红色物质析出,溶液由蓝色变成无色 | |
| C. | 红磷在空气中燃烧,产生大量的白烟 | |
| D. | 铜与稀硫酸反应速率较慢,产生少量气泡 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
| 反应前 | 充分反应后装置及反应剩余物质的质量 | |
| 装置及稀盐酸的质量 | 大理石样品的质量 | |
| 342.10g | 36.00g | 369.30g |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②④ | D. | ①⑤ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铱属于金属元素 | B. | 该原子的中子数为115 | ||
| C. | 该原子中的核外电子数为77 | D. | 该原子的核电荷数为192 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 如表是某物质在不同温度时的溶解度,请回答下列问题
如表是某物质在不同温度时的溶解度,请回答下列问题| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 13.3 | 31.6 | 63.8 | 110 | 169 | 246 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
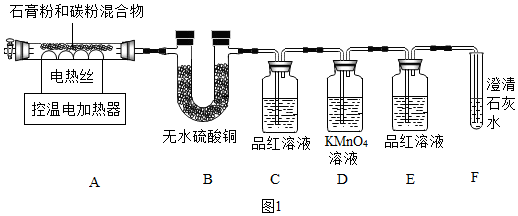
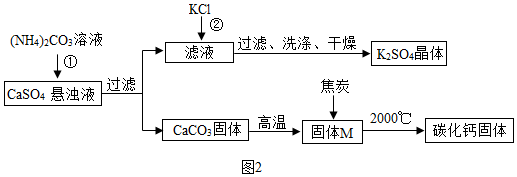
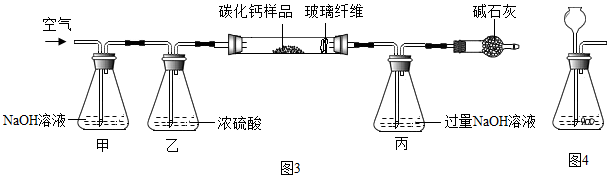
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com