
【题目】下图是氢气和氯气发生反应的微观模拟图,“![]() ”代表氢原子,“
”代表氢原子,“![]() ”代表氯原子,请回答下列问题:
”代表氯原子,请回答下列问题:
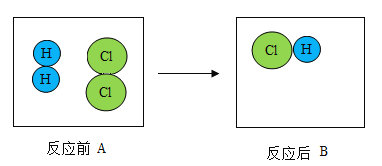
(1)在B图中将相关粒子图形补充完整_____。
(2)A中两种分子的相同点是_____。
(3)某元素的原子比一个B分子少两个质子,画出该原子的离子结构示意图_____。
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:初中化学 来源: 题型:
【题目】某化学兴趣小组的同学,通过咨询老师准备用亚硫酸钠溶液与浓硫酸反应来制备一定量的SO2(Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H 2O),老师给他们提供了一瓶久置的亚硫酸钠溶液,兴趣小组的同学分成甲、乙两小组对该瓶亚硫酸钠溶液成分进行实验探究。
(查阅资料)
① Na2SO3不稳定,在空气中易被氧气氧化成Na2SO4;
②SO32-、SO42-均能与Ba2+反应产生白色沉淀;
③BaSO3 等亚硫酸盐能与稀盐酸反应,其反应原理与 BaCO3等碳酸盐与稀盐酸反应类似。
(1)(提出问题)①该瓶溶液中溶质的成分是什么?
②该瓶溶液中亚硫酸钠的质量分数是多少?
(分析问题) Na2SO3变质的原因是:_______________________。(用化学方程式表示)
(2) (作出猜想)
猜想1:没有变质,成分是Na2SO3;
猜想 2:完全变质,成分是Na2SO4;
猜想3:_____________。
(实验探究Ⅰ)甲、乙两组分别进行实验探究溶液是否变质:
小组 | 实验操作 | 现象 | 结论 |
甲组 | 取少量样品于试管中加入过量稀盐酸; | 产生气泡 | 没有变质,还是Na2SO3 |
乙组 | 取少量样品于试管中加入氯化钡溶液,再加入足量稀盐酸。 | 产生白色沉淀后 ________ | 已部分变质 |
甲组同学实验中发生的化学方程式为:________________________。有同学质疑甲组方案不合理,理由是_________________。
(3) (实验探究Ⅱ)甲组设计如下实验装置测定Na2SO3溶液的溶质质量分数。(已![]() )
)

①要测定Na2SO3溶液的溶质质量分数,实验中需要测得的数据是亚硫酸钠溶液样品的质量以及_______质量。
②D装置的作用为______________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】右图为甲、乙两种固体物质(不考虑结晶水) 的溶解度曲线。下列说法错误的是
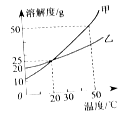
A.20 ℃时,甲、乙具有相同的溶解度
B.甲、乙的溶解度都随温度的升高而增大
C.20 ℃时,可以配制溶质的质量分数为25%的甲溶液
D.50℃时,甲和乙各30g分别加入100g水中,充分溶解后同时等速降温,则乙溶液中先有固体出现
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有FeCO3和CuO的混合物31.2g,进行如下实验,把混合物全部加入到100g适量的硫酸溶液中,恰好完全反应溶解,然后滴加适量的质量分数为16%的氢氧化钠溶液,直到恰好不再有沉淀生成,共用去150g 氢氧化钠溶液,混合物中FeCO3的质量分数为( )
A.30%B.74.4%C.70%D.25.6%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某碳酸钠样品中混有一定量的氯化钠固体和不溶于水也不与酸反应的杂质,为测定碳酸钠的纯度,化学兴趣小组做了如下的实验:
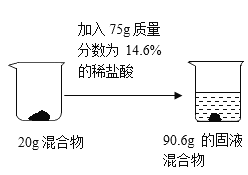

(1)请写出发生反应的化学方程式____________。
(2)根据已知条件,写出求解20g固体中参加反应的物质质量的比例式_____________。
(3)固体混合物中碳酸钠的纯度为________。
(4)若用36.5%的浓盐酸配制实验所需的稀盐酸,则需要水的质量为______________。
(5)若向最终滤液中加入12.15g水,所得不饱和溶液中溶质质量分数为_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】同学们在学完酸的化学性质后,做了如下实验:
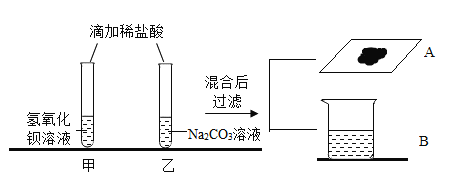
[观察与讨论1]乙试管中观察到_____现象,小组的同学们将实验后溶液混合起来对废液进行处理,混合过程中产生气泡,于是小组同学得出反应后甲试管中的溶质是_____,充分反应后过滤,得到滤液B和滤渣A,向滤渣中加稀硝酸,发现固体表面产生气泡,同学们接着对滤液B中的成分进行探究。
[提出问题1]滤液B中的含有哪些离子?
[猜想与假设]小欣同学猜想:Na+、Cl-
小研同学猜想:Na+、Cl-、SO42-
小洋同学猜想:Na+、Cl-、Ba2+、H+
你的猜想_____(一种即可)
[实验与探究]小研同学认为不需要证明就可得出_____的结论是错误的。
小研同学为证明自己猜想正确,取滤液少量加入足量的氯化钡溶液,发现溶液中产生白色沉淀,继续加入足量稀盐酸,一段时间后观察,固体不消失,则证明自己结论正确。请你对她的结论进行评价_____。
为了进一步证明滤液中离子成分,小群同学取滤液少量加入_____,根据产生的现象即可得出滤液中的离子成分。
[归纳总结]通过以上实验我们能够总结出,在研究反应后溶液中离子成分时,首先应该根据实验现象判断出_____的离子是一定不存在的。在探究过程中,加入试剂后,对物质在_____的现象,进行系统地、细致地观察和描述,得出可靠的结论。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】汽车尾气中含有许多有害气体,使用催化转换器可减少有害气体的排放,其中某一反应过程的微观变化如图所示。
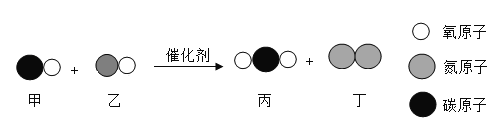
(1)请标出丁中所含元素的化合价________;
(2)甲、乙、丙、丁四种气体中密度最大的是_________(填序号),保持丙物质化学性质最小的粒子是________(填名称);
(3)参加反应的甲与乙的质量比是_________;
(4)尝试写出该转化过程的化学方程式_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学是在分子、原子层次上研究物质的科学。

(1)构成物质的粒子有分子、原子和____________。
(2)图为三种元素的原子结构示意图。氧原子在化学反应中容易____________电子(填“得到”或“失去”)。
(3)二氧化硫和二氧化碳都能与氢氧化钠溶液反应生成盐和水。将二氧化硫气体通入氢氧化钠溶液中生成亚硫酸钠和水,写出该反应的化学方程式______________。
(4)硒元素与氧、硫元素的化学性质相似,原因是它们原子的______________相同。
(5)硒元素能增强人体免疫力,延缓衰老,山药等食物中富含硒元素。硒(Se)在氧气中燃烧生成二氧化硒。写出硒在氧气中燃烧反应的化学方程式_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示,向小烧杯中通入 CO2,烧杯内 a、c 为湿润的紫色石蕊试纸,b、d 为干燥的紫色石蕊试纸,烧杯外放一只点燃的短蜡烛。
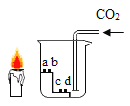
(1)能说明“CO2可与水发生反应”的现象是_______。
(2)下列说法正确的是_______(填字母序号)。
A试纸 c 比 a 先变色,说明 CO2密度大于空气
B一段时间后,蜡烛的火焰逐渐变小至熄灭,可证明 CO2密度大于空气
C若将短蜡烛放在烧杯内,蜡烛熄灭同样可证明 CO2密度大于空气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com