
【题目】下图是一种太阳能电池板示意图,回答下列问题:

(1)图中有标号的材料中,属于金属材料的是_____(填标号,下同),含有非金属单质的是_____。
(2)图中使用了两种合金。合金与纯金属相比,有许多优良性能,如:_____(写出 1 点即可)。
(3)“铜丝导线”若长时间裸露在空气中,则表面会出现一层铜绿(化学式为 [Cu2(OH)2CO3] ), 它是铜与空气中的 O2、H2O、_____(填化学式)共同反应的产物。铜绿在加热条件下会分解生成三 种氧化物,请写出铜绿分解的化学反应方程式:____________。
(4)推广使用太阳能电池的意义是:_________________________(写出 1 点即可)。
【答案】①②⑤ ③ 合金的抗腐蚀性比纯金属好(合金的硬度比纯金属大等) CO2 Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑ 节约化石能源(减少环境污染等)
2CuO+H2O+CO2↑ 节约化石能源(减少环境污染等)
【解析】
(1)图中有标号的材料中,铝合金、铜丝、合金钢支架属于金属材料,硅属于非金属单质。故填:①②⑤;③;
(2)合金与纯金属相比,有许多优良性能,如硬度大,抗腐蚀性好等。故填:合金的抗腐蚀性比纯金属好(合金的硬度比纯金属大等);
(3)由质量守恒定律,反应前后元素种类不变,生成铜绿[Cu2(OH)2CO3],铜绿中含有碳元素,空气中含有碳元素的气体是二氧化碳,这是铜与O2、H2O、CO2反应的产物;铜绿在加热条件下会分解生成氧化铜、二氧化碳和水,反应的化学反应方程式:Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑。故填:CO2;Cu2(OH)2CO3
2CuO+H2O+CO2↑。故填:CO2;Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑;
2CuO+H2O+CO2↑;
(4)推广使用太阳能电池,能节约化石能源、减少环境污染等。故填:节约化石能源(减少环境污染等)。


科目:初中化学 来源: 题型:
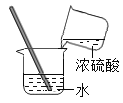
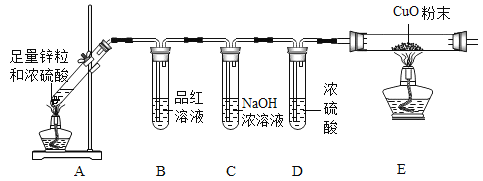
【题目】某学习小组想用锌和稀硫酸反应制取氢气,他们按照如图所示操作对浓硫酸进行稀释。某同学提出锌和浓硫酸是否也能产生氢气呢?于是他将少量浓硫酸加入到盛有锌粒的试管中,发现生成的气体具有刺激性气味。同学们对产生的气体很感兴趣,于是进行了探究。
(猜想与假设)
气体是:①H2 ②SO2 ③H2和SO2
同学们经过讨论,便直接否定了猜想①,原因是_______
(查阅资料)
(1)浓硫酸具有强氧化性,它与一些金属单质反应会产生二氧化硫气体
(2)二氧化硫能使红色品红溶液褪色
(3)氢气具有还原性
(进行实验)
(解释与结论)
(1)同学们稀释浓硫酸时,玻璃棒的作用是_______。
(2)写出锌与稀硫酸反应的化学方程式_______。
(3)装置中氢氧化钠浓溶液的作用是_______。
(4)通过此实验,同学们证明了猜想③正确,请写出他们依据的实验现象_____。
(反思与评价)
经过讨论,小组中某个同学认为上述实验有不妥之处,他将上述实验进行改进,将足量锌粒换成少量锌粒,重复实验,得出猜想②正确。
(5)补全锌和浓硫酸反应的化学方程式:Zn+2H2SO4(浓)=ZnSO4+SO2↑+______
(6)请解释第一次实验中得到氢气的原因________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请根据如图装置回答问题:
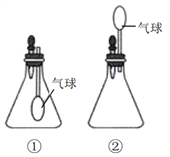
(1)使用装置①进行实验时,将滴管中的氢氧化钠溶液加入到盛有二氧化碳的锥形瓶中,可观察到的现象是__________,原因是 _________________________。
(2)使用装置②进行实验时,将滴管中的物质加入到锥形瓶中,发现气球鼓起来,请你推测锥形瓶中的物质可能是________,滴管中对应的物质可能是_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在一个密闭容器中,有甲、乙、丙、丁、戊五种物质,在一定条件下发生反应,测得反应前后各物质的质量变化量如图所示(图中正数表示物质质量的增加量,负数表示物质质量的减少量,0表示物质质量不变),下列说法正确的是
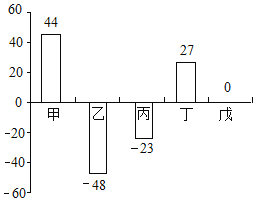
A.甲和丁是该反应中的反应物
B.甲、丁的相对分子质量之比一定为 44:27
C.参加反应的乙、丙的质量比一定为 48:23
D.戊一定是该反应的催化剂
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在一密闭容器中,有甲、乙、丙、丁四种物质,反应前他们的质量如图中白色条形所示,反应后他们的质量如图中黑色条形所示,下列说法正确的是( )
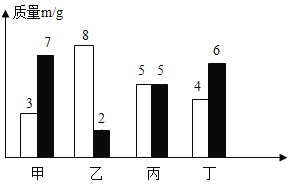
A.该反应中甲是反应物
B.丙一定是该反应的催化剂
C.该反应为化合反应
D.甲和丁的质量变化之比为2:1
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上用钛白渣[主要成分为 FeSO4 ,还含有少量 Fe2(SO4)3、MgSO4及 TiOSO4 ]为主要原料生产氧化铁黄(FeOOH)的一种工艺流程如下:

(背景信息)
a 在“溶解”时,TiOSO4 跟水发生反应,生成难溶于水的 H2TiO3和另一种溶于水的酸;
b 在“除杂”时,加入 NH4HF2 固体是为了使溶液显弱碱性,使 Mg 2+ 能与 OH-结合生成沉淀,从而可除去 Mg 2+ ;
c 在“氧化”中,Fe 3+与 OH-也可能结合成沉淀。
(1)操作 X 的名称是_______________。
(2)TiOSO4 与水发生反应的化学方程式为_________________________________。
(3)实验测得“氧化”时溶液的温度、pH 对氧化铁黄产率的影响如下图所示。

①氧化时反应的温度最适宜控制在_________________℃。
②氧化时最好控制 pH 在_____________左右,pH 过小或过大均会导致氧化铁黄产率偏低。请分析pH 过大会导致氧化铁黄产率偏低的可能原因:___________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】三种物质在密闭容器中发生反应,反应前后质量比例的变化关系如图所示,下列说法正确的是( )

A.反应中CaO为催化剂 B.该反应是复分解反应
C.反应后容器中固体质量减少 D.反应后容器中氧元素质量分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com