
【题目】碱式碳酸镁[Mg2(OH)2CO3]和过氧化镁(MgO2)都是重要化工原料。
(1)煅烧Mg2(OH)2CO3得到三种氧化物,其中一种常温下是气体,且能使澄清石灰水变浑浊。煅烧时反应的化学方程式为_______。
(2)向上述实验中所得固体中加双氧水充分搅拌,发生反应MgO + H2O2 == MgO2+ H2O,温度升高,说明该反应______热量(填“放出”或“吸收”)。
(3)实验中在测定MgO2产率时需要用到质量分数10%的稀盐酸110g,假如用37%的浓盐酸来配制,需要加水_______g。(计算结果保留一位小数)
(4)MgCl2是制备Mg2(OH)2CO3的原料。现用含碳酸镁84%的菱镁矿制备MgCl2,反应如下:MgCO3 + Cl2 + CO ==== MgCl2 + 2CO2 (设杂质不参加反应)。生产19吨MgCl2需要这样的菱镁矿_________吨?(写出计算过程)
【答案】 Mg2(OH)2CO3![]() 2MgO + CO2↑+H2O 放出 80.3 20t
2MgO + CO2↑+H2O 放出 80.3 20t
【解析】(1)烧Mg2(OH)2CO3得到三种氧化物,其中一种常温下是气体,且能使澄清石灰水变浑浊,故三种氧化物是二氧化碳和水和氧化镁,故反应方程式为Mg2(OH)2CO3![]() 2MgO + CO2↑+H2O;
2MgO + CO2↑+H2O;
(2)该反应的温度升高,说明该反应是放热反应;
(3)用37%的浓盐酸来配制质量分数10%的稀盐酸110g需要37%的浓盐酸的质量为x,则37%x=110g ![]() ,解得x=29.7g,故需要加入水的质量为110g-29.7g=80.3g;
,解得x=29.7g,故需要加入水的质量为110g-29.7g=80.3g;
(4)设生产19吨MgCl2需要需要碳酸镁的质量为x
MgCO3 + Cl2 + CO ==== MgCl2 + 2CO2
84 95
x 19t
![]() =
=![]() ,解得,x=16.8t
,解得,x=16.8t
故需要含碳酸镁84%的菱镁矿的质量为16.8t![]() =20t
=20t
答:生产19吨MgCl2需要这样的菱镁矿20t。


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
【题目】被国外友人称作“新四大发明之一”的高铁,大方便人们的出行。
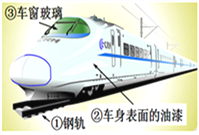
(1)图中标示的物质中为金属材料的是_____(填序号),动车电路中的导线大多选用铜制造的,这是利用了铜的延展性和_____性。
(2)动车表面喷漆主要是为了防止外壳生锈,其原理是_________。
(3)修建铁路所需的大量钢铁是以铁矿石为主要原料冶炼而得。写出一氧化碳和赤铁矿炼铁的化学方程式:______________。
(4)高铁酸钠(Na2FeO4)是高铁列车上常用的一种“绿色环保高效”消毒剂,其中高铁酸钠中铁元素化合价为__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属及金属材料在生产、生活中有广泛的应用,认识金属的性质有利于我们更好地利用金属。
(1)铁钉在初中化学实验中多次出现,如图展示了光亮铁钉的一系列变化。
![]()
(ⅰ)变化①中发生反应的化学方程式是____。
(ⅱ)变化③中除去铁锈的化学方程式为____。
(ⅲ)如果用a、b、c分别代表光亮的铁钉、锈蚀铁钉、无锈铁钉,则它们的质量由大到小的顺序为____(用字母表示)。
(2)下列几种实验方案中,可用来验证铝、铜、银三种金属的活动性顺序的是____(填序号)
①将铝、银分别浸入到硫酸铜溶液中 ②将银分别浸入到硫酸铝、硫酸铜溶液中
③将铜、银分别浸入到硫酸铝溶液中 ④将铜分别浸入到硫酸铝、硝酸银溶液中
⑤将铝浸入硫酸铜溶液、将铜浸入硝酸银溶液中
(3)在氯化铜和氯化亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,得到滤渣和滤液.通过分析,判断:
①滤液中一定含有的溶质是____(填化学式);
②向滤渣中滴加稀盐酸,有气泡产生,则滤渣中一定含有的物质是____(填化学式)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氯化钠是一种重要的化工原料。电解氯化钠溶液可制得氯气、氢氧化钠和氢气,反应的化学方程式为2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH。现取一定质量的氯化钠溶液进行电解,当氯化钠完全反应时,得到85.4g溶液,生成氢气的质量与时间的关系如图所示。请计算:
Cl2↑+H2↑+2NaOH。现取一定质量的氯化钠溶液进行电解,当氯化钠完全反应时,得到85.4g溶液,生成氢气的质量与时间的关系如图所示。请计算:
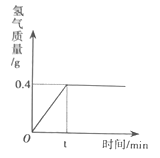
(1)氯化钠完全反应时生成氢气的质量是_________g。
(2)氯化钠完全反应时,生成氢氧化钠的质量是_________克?
(3)原氯化钠溶液中溶质的质量分数是_________?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】掌握化学用语是学好化学的关键,下列关于化学用语说法正确的是()
① N ② Na+③![]() ④ P2O5⑤ KClO3
④ P2O5⑤ KClO3
A. 表示物质组成的化学式有①④⑤
B. 表示阳离子的有②③
C. ④中数字“5”表示五氧化二磷中有5个氧原子
D. ⑤中氯元素的化合价为+3
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量分数如图所示,下列说法正确的是
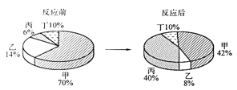
A. 丙一定是单质 B. 该反应一定是化合反应
C. 反应中甲、乙的质量比为5∶1 D. 丁一定该反应的催化剂
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲乙丙三种物质均不含结晶水,溶解度曲线如下图所示,下列分析错误的是
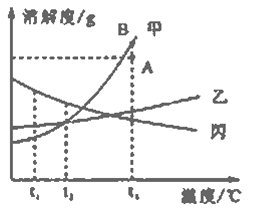
A. 甲中含有杂质乙,可采用加水溶解、蒸发浓缩、冷却结晶、过滤的方法提纯甲
B. 将A点降温到t1℃甲、乙、丙均变为不饱和溶液
C. t2℃时,甲、乙、丙饱和溶液中,丙质量分数最大
D. 将甲中A点变成B点可采用恒温蒸发溶剂的方法
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列实验设计不能达到其对应实验目的的是( )
A.  测定空气里氧气的含量 B.
测定空气里氧气的含量 B.  检查装置的气密性
检查装置的气密性
C. 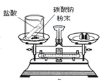 验证质量守恒定律 D.
验证质量守恒定律 D.  证明CO2密度比空气的大
证明CO2密度比空气的大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙、两三种固体物质(均不含结晶水)的溶解度曲线。下列说法正确的是
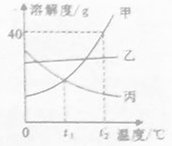
A. 甲和丙的溶解度相等
B. 在t2℃时,将28g甲物质加入到50g水中,充分溶解后所得溶液的质量为78g
C. 将t2℃时,甲的饱和溶液降温到t1℃,有晶体析出
D. 将t1℃时,甲、乙、丙三种物质的饱和溶液升温至t2℃(不考虑水的蒸发),所得溶液中溶质的质量分数由大到小的顺序是甲>Z>丙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com