
| 选项 | 物质 | 操作方法 |
| A | Fe(Fe2O3) | 加入过量稀盐酸,充分反应后过滤 |
| B | CaO粉末(CaCO3粉末) | 加足量的水,充分搅拌后过滤 |
| C | FeSO4溶液(CuSO4) | 加入过量铁粉末,充分反应后过滤 |
| D | CaCl2溶液(盐酸) | 加入过量 |


科目:初中化学 来源: 题型:
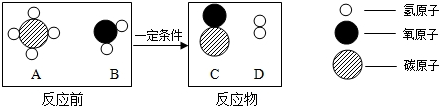
查看答案和解析>>
科目:初中化学 来源: 题型:
 某学习小组的同学在学习了Na2CO3、NaHCO3的性质后,了解到它们都能与盐酸反应产生CO2气体,那么如何鉴别Na2CO3和NaHCO3呢?带着这样的疑问,他们进行了下列探究:
某学习小组的同学在学习了Na2CO3、NaHCO3的性质后,了解到它们都能与盐酸反应产生CO2气体,那么如何鉴别Na2CO3和NaHCO3呢?带着这样的疑问,他们进行了下列探究: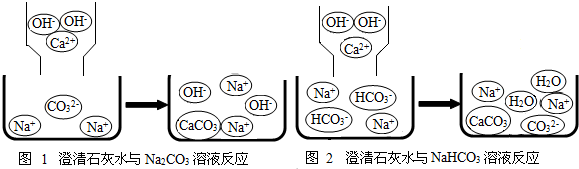
查看答案和解析>>
科目:初中化学 来源: 题型:

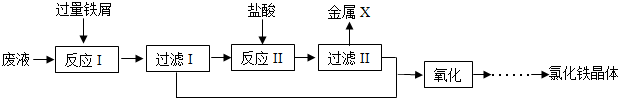
查看答案和解析>>
科目:初中化学 来源: 题型:
 如图是A、B、C三种物质的溶解度曲线.
如图是A、B、C三种物质的溶解度曲线.查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com