
| A. | 用小苏打治疗胃酸过多 | B. | 用氢氧化钠改良酸性土壤 | ||
| C. | 用铁桶长时间存放硫酸铜溶液 | D. | 用食盐水除去热水瓶中的水垢 |
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:初中化学 来源: 题型:实验探究题
| 液体名称 | 蒸馏水 | 碳酸氢钠溶液 | 碳酸钠溶液 | 氢氧化钠溶液 |
| 紫甘蓝汁液显示的颜色 | 蓝紫色 | 蓝色 | 绿色 | 黄色 |
| pH | 7.5~9 | 10~11.9 | 12~14 |
| 紫甘蓝汁液显示的颜色 | 蓝色 | 绿色 | 黄色 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 分子的质量和体积都很小 | B. | 温度升高,分子的体积变大 | ||
| C. | 分子在不停地运动 | D. | 温度越高,分子运动速率越快 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 黄铜片和纯铜片:相互刻划比较硬度 | |
| B. | 棉线和羊毛线:灼烧后闻气味 | |
| C. | 硫酸铵固体和氯化铵固体:加熟石灰混合研磨后闻气味 | |
| D. | 氢氧化钠固体和硝酸铵固体:加水溶解后测温度 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验操作步骤 | 实验现象 | 实验分析 |
| (1)取少量该化肥样品和少量氢氧化钙放在研钵中混合研磨 | 产生有刺激性气味的气体 | 含有铵根离子 |
| (2)另取少量该化肥样品于试管中,加入适量的水完全溶解,滴加足量的硝酸钡溶液,再滴加少量稀硝酸,过滤. | 产生白色沉淀, 且沉淀不溶解. | 没有碳酸根离子存在 |
| (3)取(2)所得滤液少量于试管中,滴加硝酸银溶液 | 产生白色沉淀 | 有Cl- |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
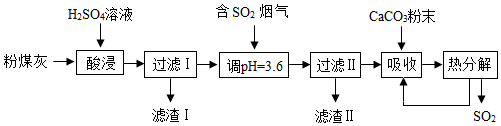
| PH值 | 0-5.5 | 5.5-8 | 8-14 |
| 存在形式 | Al3+ | Al(OH)3 | AlO2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com