
【题目】硝酸钾和氯化钠的溶解度曲线如下图所示.30℃时,分别将30g硝酸钾和氯化钠放入100g水中,充分溶解.下列结论中,不正确的是( )
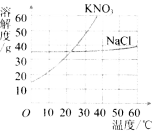
A.两种溶液中溶质的质量分数相等
B.通常情况下,采取降温的方法能将两种溶液都变成饱和溶液
C.若将硝酸钾溶液降温到20℃,溶液中溶质和溶剂的质量比为3︰10
D.若将硝酸钾溶液变为10℃时的饱和溶液,溶液中溶质的质量分数一定减小
【答案】B
【解析】此题考查溶解度曲线的意义及应用.根据溶解度曲线可知,30℃时.氯化钠和硝酸钾的溶解度都大于30g,此温度时分别将30g硝酸钾和氯化钠放入100g水中,充分溶解所形成的都是不饱和溶液,故溶质质量分数相等,A正确;硝酸钾的溶解度受温度变化影响较大,通常采取降温的方法将其变成饱和溶液,而氯化钠的溶解度受温度变化影响较小,不宜采用降温的方法将其变成饱和溶液,B错;由于20℃时硝酸钾的溶解度仍大于30g,因此,将硝酸钾溶液降温到20℃,仍是不饱和溶液,溶液中溶质和溶剂的质量比为3︰10,C正确;由于10℃时硝酸钾的溶解度小于30g,将硝酸钾溶液降温至10℃时就会变成饱和溶液,且有晶体析出,显然溶液中溶质的质量分数会减小,D正确.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:初中化学 来源: 题型:
【题目】如图所示,在托盘天平两边各放一只烧杯,调至平衡.往右边烧杯里注入一定量的稀硫酸,左边烧杯里注入相同质量的盐酸.
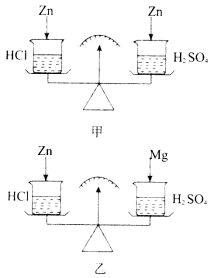
(1)如图甲所示,两边烧杯中各投入少量相同质量的锌粒,锌粒完全溶解后,天平指针有何变化?________,理由是________________________________.
(2)如图乙所示,若左边投入锌粒,右边投相同质量的镁条,锌、镁全部溶解后,天平指针有何变化?________________________________________________________,理由是________________________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校研究性学习小组的同学设计了一个对比实验,探究物质溶解于水时是放出热量还是吸收热量.他们向图中A、B、C三个实验装置中的盛有一定量水的小试管中依次加入固态NaCl、NH4NO3、NaOH(放入固体前,U形管中液面均相平).
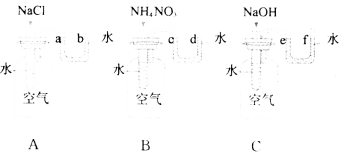
(1)请你帮他们填写下表:
A | B | C | |
现象(U形管中液面变化) | |||
原因 |
(2)从物质溶解于水的对比实验中得出的初步结论是________________________________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是甲、乙两种固体的溶解度曲线,下列说法正确的是( )
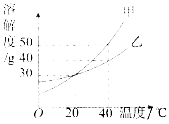
A.甲的溶解度等于乙的溶解度
B.升高温度可以将甲的不饱和溶液变为饱和溶液
C.20℃时,100g乙的饱和溶液中溶质质量是30g
D.40℃时,分别用100g水配制甲、乙的饱和溶液,所需甲的质量大于乙的质量
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硫酸铜溶液对过氧化氢(H2O2)的分解有催化作用.取8.5%的过氧化氢溶液40g倒入小烧杯中,向其中加入20%的硫酸铜溶液6.6g,使过氧化氢完全分解.计算:
(1)产生氧气的质量.
(2)反应后所得溶液中硫酸铜的质量分数.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两物质的溶解度曲线如图所示,请据图回答下列问题.
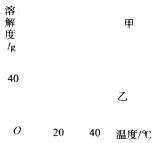
(1)20℃时,甲物质的溶解度是________g.
(2)20℃时,甲物质的饱和溶液中溶质和溶剂的质量比为________.
(3)欲将40℃时乙物质的饱和溶液变为不饱和溶液,可采用的方法是________(写一种即可).
(4)40℃时,将甲、乙两物质的饱和溶液分别降温到20℃,所得溶液中溶质的质量分数的大小关系是________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室中的试剂一般要密封保存,否则可能会与空气接触而变质.某研究性学习小组发现一瓶未密闭的KOH固体,对其成分提出以下假设,并完成了实验探究.
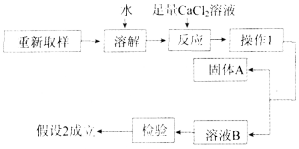
假设1:只含KOH;假设2:含KOH和K2CO3;假设3:只含K2CO3.
(1)成分中可能含有K2CO3的原因是(用化学方程式回答)________________________.
(2)取少量样品于试管中,加入足量稀盐酸,观察到________________________,说明假设2或假设3成立.
(3)进一步探究的过程如下:
①“操作1”的名称是________.
②“固体A”的化学式是________.
③加入足量CaCl2溶液的作用是________________________________________________
________________________________________________________________________.
(4)变质试剂也有利用价值,从KOH和K2CO3的组成和性质看,这瓶变质试剂的用途是____________________________________________________________________(写出一条).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】反思、归纳与提升是化学学习的重要方法.
对于复分解反应及其规律,通过反恩与探索,同学们有了新的认识.请填写下文中横线上的空白.
[知识回顾]
(1)氯化氢气体、氢氧化钠固体不导电.
(2)盐酸、氢氧化钠溶液能导电.
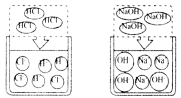
[分析归纳]
氯化氢溶于水:HCl![]() H++Cl-
H++Cl-
氢氧化钠溶于水:NaOH![]() Na++OH-
Na++OH-
结论:溶液导电是由于溶液中存在自由移动的离子.
[迁移运用]硫酸钠溶液能导电,原因是硫酸钠溶于水:Na2SO4![]() ________.
________.
[探索发现]
(1)氢氧化钠溶液与盐酸反应的微观示意图
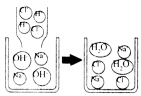
[分析归纳]
反应的化学方程式:________________________.
反应的实质:H++OH-![]() H2O,反应能进行的原因是溶液中H+和OH-的数目减少,即自由移动的离子数目减少.
H2O,反应能进行的原因是溶液中H+和OH-的数目减少,即自由移动的离子数目减少.
(2)硫酸钠溶液跟氯化钡溶液反应的微观示意图:
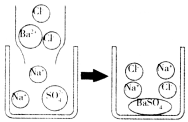
[分析归纳]
反应的化学方程式:________________________.
反应的实质:略.
反应能进行的原因是溶液中________________________的数目减少,即自由移动的离子数目减少.
(提示:该反应有硫酸钡白色沉淀生成)
(3)有气体生成的复分解反应,以Na2CO3+2HCl=2NaCl+H2O+CO2↑为例,反应实质:2H++![]()
![]() ________.
________.
[总结规律]
上述复分解反应能发生的本质原因是________________________________________
________________________________________________________________________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是某制药厂生产的“××牌”高钙片标签上的部分文字,请仔细阅读后回答下列问题:

(1)维生素D种类较多,其中维生素D2的化学式为C28H44O,试计算维生素D2的相对分子质量为________________________;维生素D2中碳、氢、氧三种元素的质量比为________________________.
(2)计算高钙片中碳酸钙的质量分数________.
(3)根据你对补钙产品的调查和已有的化学知识,判断下列物质可作为补钙产品直接服用的是________________________(填字母).
(A)氧化钙
(B)氢氧化钙
(C)葡萄糖酸钙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com