
【题目】在一定温度下,向20g Na2CO3和NaCl的固体混合物中加入101g水,溶解后,再向其中加入100g CaCl2溶液,恰好完全反应,过滤,所得滤液的质量为211g,将滤渣洗涤、干燥,称得其质量为m,试计算:
(1)m为多少g。
(2)当恰好完全反应时,所得溶液中溶质的质量分数为多少?
【答案】(1)10
(2)解:设原固体混合物中碳酸钠的质量为x,反应后生成氯化钠的质量为y。
Na2CO3+CaCl2===CaCO3↓+2NaCl
106 100 117
x 10g y
![]() =
=![]() x=10.6g
x=10.6g
![]() =
=![]() y=11.7g
y=11.7g
所得溶液中溶质的质量分数:![]() ×100%=10%
×100%=10%
答:所得溶液中溶质的质量分数为10%。
【解析】(1)由质量守恒定律可知反应前后物质的总质量不变,所以滤渣的质量=20g +101g+100g -211g=10g,由于碳酸钠和氯化反应生成碳酸钙沉淀和和易溶于水的氯化钠,所以滤渣为碳酸钙的质量,然后利用化学方程式中碳酸钠和氯化钠和碳酸钙的质量关系可计算碳酸钠和氯化钠的质量。
(2)解:设原固体混合物中碳酸钠的质量为x,反应后生成氯化钠的质量为y。
Na2CO3+CaCl2===CaCO3↓+2NaCl
106 100 117
x 10g y
![]() x=10.6g
x=10.6g
![]() y=11.7g
y=11.7g
所得溶液中溶质的质量分数:![]() ×100%=10%
×100%=10%
答:所得溶液中溶质的质量分数为10%。


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:初中化学 来源: 题型:
【题目】下表是Ca(OH)2和NaOH的溶解度数据.请回答下列问题:
![]()
(1)依据上表数据,绘制Ca(OH)2和NaOH的溶解度曲线,下图中能表示NaOH溶解度曲线的是 (填A或B).
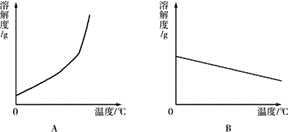
(2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:
①加入氢氧化钙,②升高温度③降低温度,④加入水,⑤蒸发水后再恢复到原温度,⑥加入生石灰.
其中措施正确的是( )
A.②④⑥ B.③④ C.①③⑤⑥ D.①②⑤⑥
(3)20℃时,191 g饱和NaOH溶液,蒸发10 g水后,再降温到20℃,可析出NaOH晶体的质量为 .
(4)现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶液中溶质的质量分数乙 甲(填“>”、“<”或“=”).
(5)现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是 .
(6)20℃时,欲测定NaOH溶液的pH,若先将pH试纸用蒸馏水润湿,再进行测定,则所测溶液的pH (填“偏大”、“偏小”或“不受影响”).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(7分)实验室利用下列装置可以制取某些气体,请据图回答问题:
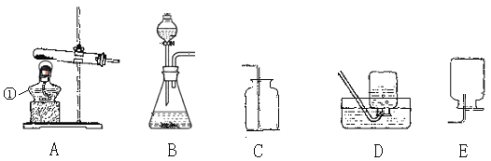
(1)这五个装置示意图中,有一个装置是错误的,指出错误装置是 (填序号)。
(2)图示中仪器①的作用 ;实验室用高锰酸钾来制取氧气,可选择A作发生装置,但要对A进行改进,改进的方法是 ;实验室若用B作发生装置制氧气,则该反应方程式为 。
(3)常温下,硫化氢(H2S)是一种有臭鸡蛋气味的气体,实验室可用硫化亚铁(FeS)固体和稀硫酸反应制得,该反应方程式为FeS + H2SO4(稀)= H2S↑+Fe SO4 ,则应选择
(填序号,下同)来作发生装置。
(4)NO气体难溶于水,密度略大于空气,易与氧气反应生成NO2,则应选择 装置来收集NO。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学课外小组的同学,为了测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如图所示的装置(图中铁架台已经略去),实验在27℃、101kPa下进行。

实验步骤如下:
①按图连接好装置;
②用天平准确称取氢氧化钠样品m g,放入A中试管内,向B中集气瓶内倒入饱和二氧化碳水溶液至瓶颈处;
③向分液漏斗中倒入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞。反应结束后,量筒中收集到饱和二氧化碳水溶液V mL;
④计算氢氧化钠样品中碳酸钠的质量分数。
请回答下列问题:
(1)氢氧化钠发生变质的化学方程式:_________________。
(2)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是____________。
(3)B中集气瓶盛装的饱和二氧化碳水溶液不能用水代替,其原因是_________________________。
(4)叙述检验氢氧化钠部分变质的方法:

______________________ ____________________ _________________
(5)取10g变质的氢氧化钠于烧杯中,其中碳元素的质量分数为6%,向烧杯中加入100g一定质量分数的稀盐酸(足量),则反应结束后烧杯内物质的总质量是____g。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图像能正确反应对应变化的是(____)
A |
| 向一定质量的盐酸中加入镁粉至过量 |
B |
| 向一定量的铁粉和铜粉的混合物中加入硫酸铜溶液 |
C |
| 加热一定量的高锰酸钾固体 |
D |
| 向氢氧化钠溶液中加入X,X可能是________ |
A. A B. B C. C D. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硅是一种重要的半导体材料,应用范围广。三氯硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程如图所示:

(1)写出上述流程中一种氧化物的化学式:______________;
(2)上述流程中最后一步反应的化学方程式为____________________________,该反应属于________(填基本反应类型)反应;
(3)如果还原SiHCl3过程中混入O2,可能引起的后果是________;
(4)该流程中可以循环利用的物质的化学式是__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硅是一种重要的半导体材料,应用范围广。三氯硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程如图所示:

(1)硅属于__________(选填“金属”或“非金属”)元素;
(2)写出上述流程中一种氧化物的化学式:______________________;
(3)上述流程中最后一步反应的化学方程式为______________________________,该反应属于________(填基本反应类型)反应;
(4)如果还原SiHCl3过程中混入O2,可能引起的后果是________________________;
(5)该流程中可以循环利用的物质的化学式是____________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属具有广泛的应用。
(1)下列金属制品中,利用金属导热性的是________(填字母)。

(2)波尔多液是一种农业上常用的杀菌剂,它由硫酸铜、生石灰加水配制而成,不能用铁质容器配制波尔多液的原因是__________________________________________(用化学方程式表示)。
(3)防止金属锈蚀是保护金属资源的有效途径之一。洁净的铁钉在下列情况下容易生锈的是________(填字母)。
A.在干燥的空气中
B.在潮湿的空气中
C.浸没在植物油中
(4)铝具有良好的抗腐蚀性能,原因是铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化。氧化铝难溶于水,却能溶于酸。写出氧化铝与稀硫酸反应生成硫酸铝和水的化学方程式:____________________________________________。
(5)向铁粉和氧化铜粉末的混合物中加入一定量的稀硫酸,微热,充分反应后过滤,得滤渣和滤液,向滤液中加一洁净铁片,未看到铁片有任何变化。则滤液中含有的溶质是______________(填化学式,下同),滤渣中一定含有的物质是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com