
【题目】南海钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源,我国制碱工业先驱侯德榜发明了“侯氏制碱法”,在充分利用海洋资源的基础上,结合“侯氏制碱法”的基本原理,可模拟实现工业生产纯碱的过程如下(某些反应产物以略去):
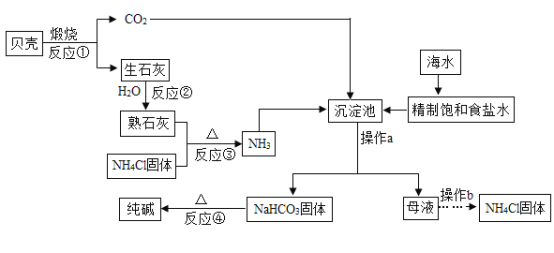
回答下列问题:
(1)操作a的名称是____, 在该操作中常使用烧杯、玻璃棒和_______这三种玻璃仪。
(2)“侯氏制碱法”的主要产品“碱"是指_____ (填化学式)。
(3)在沉淀池中发生的反应是:将NH3、CO2、饱和氯化钠溶液反应,生成NaHCO3固体和NH4Cl溶液,请写出该反应的化学方程式____________________________。
(4)仔细观察流程图,其中可循坏利用的物质除二氧化碳之外,逐有_________。
【答案】过滤 漏斗 Na2CO3 NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl NH4Cl
【解析】
(1)固液分离操作是过滤,该操作用到的玻璃仪器有烧杯、玻璃棒、漏斗,故填:过滤;漏斗。
(2)“侯氏制碱法”的主要声品“碱"是指纯碱碳酸钠,化学式是Na2CO3,故填:Na2CO3。
(3)NH3、CO2、饱和氯化钠溶液反应,生成NaHCO3固体和NH4Cl溶液化学方程式为;NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl,故填:NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl。
(4)氯化铵及是反应物又是生成物,是可循环利用的物质,故填:NH4Cl。


科目:初中化学 来源: 题型:
【题目】向装有等量水的A、B、C三个烧杯中分别加入10g、25g、25 g NaNO3固体,在不同温度下充分溶解后,现象如图1所示。
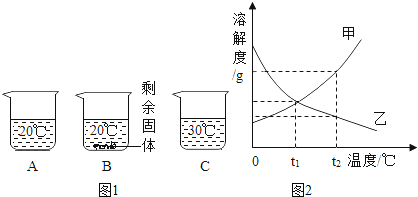
(1)烧杯中的溶液一定属于饱和溶液的是__________(选填“A”、“B”或“C”序号)。
(2)图2中能表示NaNO3溶解度曲线的是____________(填“甲”或“乙”)。
(3)要使B烧杯中剩余的固体继续溶解,可采用的方法是__________。
(4)由上图2分析,若分别将100g甲、乙两物质的饱和溶液从t2℃降温到t1℃,对所得溶液的分析正确的是__________(填序号)。
A甲、乙都是饱和溶液 B所含溶剂质量:甲<乙
C溶液质量:甲>乙 D溶质质量分数:甲>乙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种固体物质的溶解度曲线如图.回答下列问题:
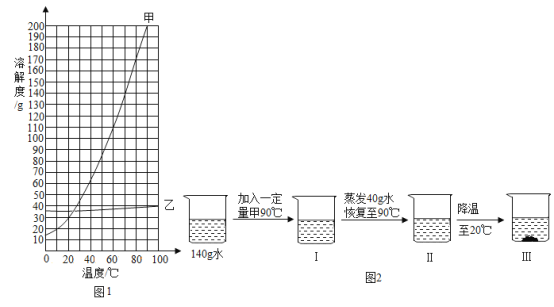
①在10℃时,甲、乙两种物质的溶解度大小关系为_____。
②某温度下,将甲的不饱和溶液转化为饱和溶液的方法之一是_____。
③甲物质中含有少量乙物质时,提纯甲的方法是_____。
④取一定量的甲物质和水进行如图2所示操作:若Ⅲ中析出116g固体(不含结晶水),则加入甲的质量是_____g; 下列对上述过程的分析正确的是_____。
A Ⅰ中溶液为不饱和溶液
B Ⅱ中溶液可能是饱和溶液
C 开始析出固体甲的温度在 70℃至 80℃之间
D 烧杯中溶液的溶质质量分数是Ⅱ>Ⅲ>Ⅰ
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验课上,同学们利用下列装置进行气体制备的学习。请回答下列问题:
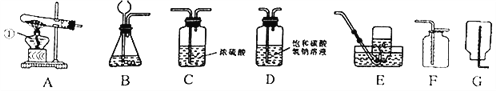
(1)编号①的仪器名称是_____。
(2)用加热法制取氧气,所选择的发生装置是_____ (填字母,下同),收集装置是_____,反应的化学方程式为_____。
(3)若要制取瓶纯净、干燥的二氧化碳气体 (常混有少量氯化氢气体和水蒸气,装置连接的正确顺序是:产生气体→_____→_____→F.检验二氧化碳气体的方法是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国正在组织实施以天基互联网接入为主要目标的“虹云工程”,将由156颗卫星组网运行,完成业务星座的构建。
(1)卫星的发射离不开火箭,有些火箭使用液体燃料,如偏二甲肼( C2H8N2)与四氧化二氮、液氢和煤油等,偏二甲肼属于___( 填有机物”或“无机物”),四氧化二氮中氮元素和氧元素的质量比是_____ (填最简比)。
(2)铝合金是一种常用的航天材料,铝的金属活动性比铁的强,但铝制品却有较强的抗腐蚀性,其原因是__________________。(用化学方程式表示)。
(3)已知铝原子的结构示意图及铝在元素周期表中的部分信息如图所示,下列说法正确的是(__________)

A 、铝原子的中子数为13 B、 x的值为13
C 、铝元素在化学反应中易失去电子 26.982 D、 一个铝原子的质量为26. 98g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有6.4gM和氧气充分反应,生成4.4gCO2 、2.8gCO和7.2g水。则参加反应的氧气的质量为______克;此反应的化学方程式为_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】右图所示,某河旁甲、乙、丙、丁四座化工厂排放的工业废水中分别含有碳酸钠、氯化铜、氢氧化钠、盐酸中的一种.某同学对①、②、③、④处水质监测时记录了以下现象.根据现象推断,甲、乙、丙、丁四座化工厂排放工业废水的成分,错误的是( )
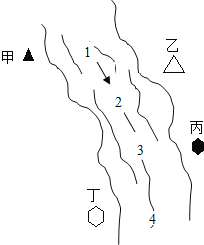
① | ② | ③ | ④ | |
记录现象 | 无色溶液 | 蓝色浑浊 | 浑浊消失 | 产生气泡 |
A.甲:碳酸钠 B.乙:氯化铜 C.丙:盐酸 D.丁:碳酸钠
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在过氧化氢溶液的分解反应中,某化学兴趣小组发现:除了二氧化锰,硫酸铜溶液也能对H2O2的分解起催化作用。对此,他们进行了有关探究。
(提出问题)CuSO4溶液是混合物,是其中哪一种成分起到了催化作用呢?
(查阅资料)①稀硫酸中主要含有H2O、H+、SO42三种微粒。
②CuSO4溶液中主要含有H2O、Cu2+、SO42三种微粒。
(作出猜想)根据以上信息,同学们作出了如下三个猜想:
Ⅰ:SO42催化分解H2O2 Ⅱ:Cu2+催化分解H2O2 Ⅲ:H2O催化分解H2O2
(1)其中,明显不合理的是_______(填序号),理由是_______。
(实验验证)
(2)为了验证自己的猜想,同学们设计了如下两个实验(所取H2O2溶液的浓度相同):
操作 | 现象 | 结论 |
取5 mL H2O2溶液于试管中,滴入少量的稀硫酸,伸入带火星的木条 | _______ | SO42对H2O2的分解不起催化作用 |
_______ | 产生大量气泡,带火星的木条复燃 | _______ |
(实验拓展)
实验一:用图甲装置探究影响H2O2分解速率的因素,得到图乙、图丙所示曲线(在等温条件下,产生氧气体积与装置内压强成正比,反应放热忽略不计)。
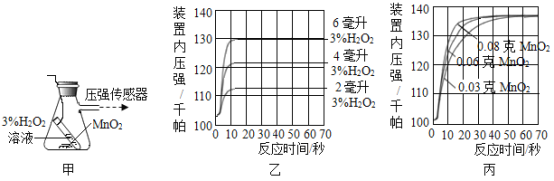
(3)写出图甲中反应的化学方程式_______。
(4)图乙是“0.1 g MnO2与不同体积的3% H2O2溶液混合”的实验结果,从图中可以看出_______。
(5)图丙是用“8 mL浓度为3%的H2O2溶液与不同质量的MnO2混合”时,所得到的曲线,通过该曲线可以得到的结论是_______。
实验二:用图丁装置探究氧气的浓度对燃烧的影响。点燃蜡烛后立即塞紧橡皮塞,待蜡烛熄灭后,将滴管中的水全部滴入瓶中,铝盒中的白磷燃烧。
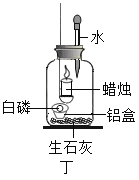
(6)白磷燃烧的主要现象是_______。
(7)由“蜡烛熄灭,白磷燃烧”可得出的结论是_______。
(8)滴入水后白磷燃烧的原因是_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】控制变量设计对比实验是实验探究的重要方法,请参与下列探究并回答问题:
实验一:探究影响过氧化氢溶液分解速率的因素

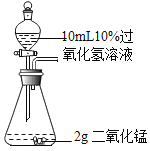
A B
同时打开A和B装置中分液漏斗的旋塞,根据锥形瓶内产生气泡的速率,得出_________会影响过氧化氢溶液的分解速率,为准确直观比较分解速率的快慢,可测定相同时间内收集到的氧气体积,或者测定_________。
实验二:探究金属与盐溶液的反应
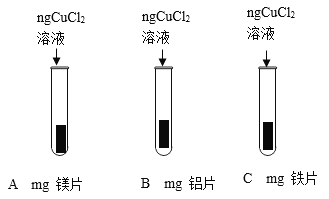
将打磨过的镁片、铝片、铁片分别与氯化铜溶液反应,观察到金属表面都有红色物质生成且镁片、铝片表面还有气泡产生,且产生气泡的速率镁比铝快,铁片表面几乎看不到气泡产生经查阅资料知氯化铜溶液呈酸性。请写出B试管内发生反应的化学方程式__________________;由此实验______________(填能或否)得出镁铝铁铜四种金属的活动性顺序。
实验三:探究二氧化碳能否与碱溶液反应
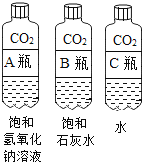
①对比 A 瓶与 B 瓶的实验现象,请说明实验室用氢氧化钠溶液吸收CO2,用石灰水检验二氧化碳的理由_________;
②A瓶与 B瓶的对比,因为 A瓶严重变瘪,说明_________消失,可证明二氧化碳与氢氧化钠溶液发生了反应,也可以通过加入下列物质中的_________证明新物质的生成,从而说明反应的发生。
A 酚酞试液 B 稀盐酸 C Ca(OH)2溶液 D CaCl2溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com