
����Ŀ�������������������벻���������ϡ�
��1����һ�������ϵ��й�֪ʶ
����ʹ�ý����Ⱥ����ˡ���ͭ������������ʱ����ֱ�������ſ�ʼ����ʹ�������ϡ���Ҳ��ӳ��Cu��Fe��Al���ֽ����Ļ����ǿ������˳������
��2������˵������ȷ������������ĸ��ţ�
A����˿�������о���ȼ�գ��������䣬������������
B�����շϾɽ��������ڽ�Լ������Դ��
C������Ͱ�м�������ͭ��Һ��ʯ����������ũҩ������Һ��
D�����������ڳ������ˣ������������ĵ�����
����Ʒ��ʴ�Ĺ��̣�ʵ��������������е��ȷ�����ѧ��Ӧ�Ĺ��̡���д��һ�ַ����ʩ ��
��3��(��)�������̽�����ֳ���������Ʒ������������ػ�����ش��������⡣
����һ������AgNO3��Cu(NO3)2�����Һ������������ͼ��ʾ��ʵ�飬������ҺA����B�ijɷֽ����˷������о���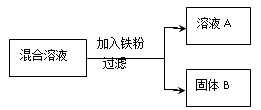
��������⡿��ҺA�е����ʿ�������Щ��
���������롿
��ֻ��Fe(NO3)2 ����Fe(NO3)2 ��AgNO3
����Fe(NO3)2 ��Cu(NO3)2 ������
��4�����������ۡ��������IJ����������ţ���
��5����ʵ��̽���������±��е�ʵ�鲽�輰������ɱ��е�ʵ�����
ʵ�鲽�� | ���� | ʵ����� |
ȡ��������B���μ�ϡ���� | �����ݲ��� | ��ҺA�е����ʳɷַ��ϲ��� �� |
��6�������ݴ�������ȡ10�˹���B���ձ��У����ձ��м���100��ϡ���ᣬǡ����ȫ��Ӧ��Ƶ��ձ��ڻ�����������Ϊ109.8�ˡ������
����ϡ�����������������Ϊ���٣�����д��������̣�
��7������������Ũ�ȵ�ϡ����100�ˣ�������������98%��Ũ�����ˡ�
���𰸡�
��1��Al��Fe��Cu
��2��A C,ˮ������,Ϳ�͡��Ʋ�
��3��Fe(NO3)2 ��Cu(NO3)2 ��AgNO3
��4���ڢ�
��5��Fe,Cu��Ag
��6���⣺��ȡ10�˹���B���ձ��У����ձ��м���100��ϡ���ᣬǡ����ȫ��Ӧ��Ƶ��ձ��ڻ�����������Ϊ109.8�ˡ��������غ㶨�ɿ�֪����Ӧǰ�����ʵ����������䣬��������������Ϊ��10��+100��-109.8��=0.2�ˣ�����ϡ�������������Ϊx,��
Fe + | H2SO4 = FeSO4 + | H2�� |
98 | 2 | |
x | 0.2g |
98/x=2/0.2g x=9.8g
����ϡ�����������������Ϊ9.8g��100g��100%=9.8%
��7��10
��������(1).���������ֻ�����ķ�Ӧ���������Խǿ��Խ����ұ��������Ȼ����Խ���Ի�������ʽ���ڣ���Ӧ��Խ����Խ���Ե��ʴ��ڻ���Խ�ױ�ұ���ɽ������ʡ���������ʹ�ý����Ⱥ����ˡ���ͭ������������ʱ����ֱ�������ſ�ʼ����ʹ�������ϡ���Ҳ��ӳ��Cu��Fe��Al���ֽ����Ļ����ǿ������˳����Al��Fe��Cu (2). ��˿�������о���ȼ�գ��������䣬���������������������˳�����K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au���ڽ����˳����У�������ǰ�ߵĽ����ܺ��ᷢ���û���Ӧ�����κ�������������λ��Խ��ǰ�������Ļ��Խǿ��λ�ÿ�ǰ�Ľ����ܽ�λ�����Ľ�������������Һ���û���������������������ͭ��Һ��Ӧ�������������Ͱ�м�������ͭ��Һ��ʯ����������ũҩ������Һ�� (3����Ʒ��ʴ�Ĺ��̣�ʵ��������������е�������ˮ����ѧ��Ӧ�Ĺ��̣����Է�ֹ����ķ����У����ֽ�������ྻ������DZ����㡢�ı��������ɺͽṹ�� (5). ��һ������AgNO3��Cu(NO3)2�����Һ�������ۣ���������������Ӧ��ʣ�������������ͭ��Ӧ���������������������������������ͭ��Ӧ�꣬����Һ��ֻ��Fe(NO3)2 �����������ֻ�ܽ���������Ӧ�꣬��������������ͭ��Ӧ���߷�Ӧ����������ͭ����Һ����Fe(NO3)2 ��Cu(NO3)2 ��������������٣�ֻ�ܷ�Ӧ��������������������ͭû�в��뷴Ӧ����Һ���� Fe(NO3)2 ��Cu(NO3)2 ��AgNO3 (6).���� �ڲ����� (7). ȡ������Ӧ��Ĺ���B���μ�ϡ���ᣬ�����ݲ�����˵������ʣ�࣬��������������ͭ����Ӧ�꣬��Һ�� ������ֻ����������(8)����B�ijɷ���ʣ���Fe �����ɵ�Cu��Ag (9). ��ȡ10�˹���B���ձ��У����ձ��м���100��ϡ���ᣬǡ����ȫ��Ӧ��Ƶ��ձ��ڻ�����������Ϊ109.8�ˡ��������غ㶨�ɿ�֪����Ӧǰ�����ʵ����������䣬��������������Ϊ��10��+100��-109.8��=0.2�ˣ�����ϡ�������������Ϊx,��
Fe + | H2SO4 = FeSO4 + | H2�� |
98 | 2 | |
x | 0.2g |
98/x=2/0.2g x=9.8g
����ϡ�����������������Ϊ9.8g��100g��100%=9.8%
��������Ũ�ȵ�ϡ����100�ˣ�������������98%��Ũ���������Ϊy
100g��9.8%=y��98% y=10g
�ʱ����Ϊ��Al��Fe��CuA Cˮ������ Ϳ�͡��Ʋ�Fe(NO3)2 ��Cu(NO3)2 ��AgNO3�ڢ�Fe ��Cu��Ag9.8%,10g
�����㾫����������Ҫ�����˽������ϵ�ѡ�����ݺͽ������˳����Ӧ�õ����֪ʶ�㣬��Ҫ���պ�ɫ������ͨ��ָ�����̡��������ǵĺϽ��ؽ�������ͭ��п��Ǧ�ȣ���ɫ��������������ơ�þ�����ȣ���ɫ������ͨ����ָ����ɫ��������������������ڽ������˳���1��������λ��Խ��ǰ�����Ļ�Ծ�Խǿ2��λ����ǰ��Ľ������û������ᡢϡ�����е��⣨������Ũ���ᡢ���ᣩ3��λ��ǰ��Ľ����ܰ�λ�ں���Ľ��������ǵ�����Һ���û�����������K��Ca��Na��������ȷ�����⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ��Ϻ���������������ɢ���ŷ�Χ����ɺ����Ⱥ���̺��о����Ŀ����Դ����ҵ��Դ�ȣ������ڶ�����˹����֮�ƣ������Դ���ڲ���������Դ���ڿ����� �� �� ��һ �� Ҫ �� ǿ�� �� ��ʶ�� �� �� �� �� �� ������ �� �� �� �� �� Դ �� ��ʩ____��____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������л������������ǻ۵Ľᾧ�����г����������ı仯���ڻ�ѧ�仯�� �ǣ� ��
A.��ˮ�ɱ�B.������C.�����ɸ�D.ĥ�Ƴ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ÿ�������ڲ��ϱ仯��������������б仯���ڻ�ѧ�仯����________
A ��ˮ��� B �ƾ��ӷ� C ������� D ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����еĹ�ú��ʯ�͡���Ȼ����˵���У�������ǣ� ��
A.���Ƕ�����̼����B.���Ƕ��ǻ����
C.���Ƕ����ڻ�ʯȼ��D.������ȫȼ��ʱ���� CO2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ������֮Դ�����й���ˮ��˵����ȷ����
A.��ˮ�����м���������ɱ������
B.ˮ����Ȼѭ����Ҫ��ͨ����ѧ�仯��ɵ�
C.Ӳˮ�к��н϶��Ca2+��Mg2+
D.���ˮʱ��������������������Ϊ2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧѧϰ�����л�Ӵ����ܶ����ݣ��������ݲ���ȷ����
A.������ˮ�ĺ���Լռ���ص�70%
B.�����ĺ�̼��Ϊ2%-4.3%
C.��������ƽ����8.13g�Ȼ��ƹ���
D.������ϡ������Լռ�������0.94%
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com