
【题目】化学老师张强指导某化学兴趣学习小组进行了一个有趣的实验探究:测定鸡蛋壳的主要成分碳酸钙的质量分数。实验如下:将鸡蛋壳洗净、干燥并捣碎后,称取7.5g放在烧杯里,然后往烧杯中加入足量的稀盐酸50mL(密度1.02g/mL),充分反应后,称得反应剩余物为55.75g(假设其他物质不与盐酸反应)。请回答:
(1)产生二氧气体的质量为 g。
(2)计算该鸡蛋壳中碳酸钙的质量分数。
 走进文言文系列答案
走进文言文系列答案科目:初中化学 来源: 题型:
【题目】某兴趣小组的同学在实验室用含有少量氯化钙的氯化钠固体配制一定质量分数的氯化钠溶液。实验步骤如下图所示:
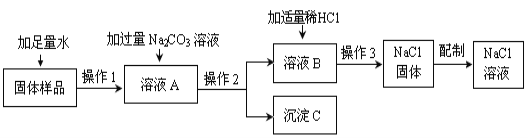
请据图回答:
(1)在“操作2”中,要用到的玻璃仪器除玻璃棒、烧杯外,还有 。
(2)加入“适量稀HCl”的目的是 。
(3)生成沉淀C的化学方程式为 。
(4)“操作3”的名称是 。
(5)在用量筒量取所需水的过程中,若俯视读数,而其余操作均正确,这样配得的溶液的溶质质量分数会 (填“偏高”、“偏低”、或“无影响”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】黄铜矿经初步处理后,所得溶液甲中的溶质为Fe2(SO4)3、CuSO4及H2SO4,利用以下实验可制取补血剂原料碳酸亚铁并回收铜。
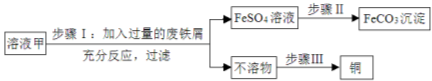
(1)步骤Ⅰ中,发生反应的化学方程式包括:
①Fe2(SO4)3+Fe 3FeSO4 ,
② ,
③ 。
(2)步骤Ⅱ中加入一种试剂可实现其转化,该试剂可以是 (填化学式)。
(3)步骤Ⅲ回收铜的实验操作包括:①过滤、②洗涤、③加足量稀硫酸、④干燥,正确的操作排序是 (填序号)。
(4)若废铁屑含有少量铁锈,对实验结果 (填“有”或“无”)影响。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某班组织了以“环境污染都是化学惹的祸吗?”为主题的辨论赛,正方观点是“环境污染都是化学惹的祸”,反方观点是“环境污染不全是化学惹的祸”。下列各项不能成为反方观点论据的是( )
A.病菌导致流感 B.汽车鸣笛产生噪音
C.燃放鞭炮形成烟雾 D.电磁辐射引发白血病
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请你结合下列装置图回答问题:
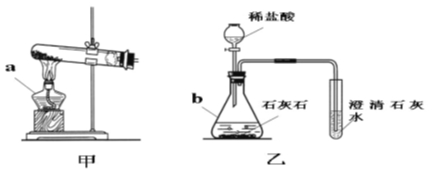
(1)写出有标号仪器的名称:a____________,b____________。
(2)实验室用甲装置制氧气的化学方程式是_________________________________,用____________法收集氧气。反应结束后冷却,往试管中加入足量的水,搅拌、过滤,得到黑色粉末。该黑色粉末与过氧化氢接触有大量气泡产生,反应的化学方程式是_______________________,黑色粉末在反应中的作用是_______________。
(3)某化学兴趣小组用乙装置制取并检验二氧化碳。实验过程中,可观察到试管里产生______色沉淀,反应的化学方程式是_________________________________。产生沉淀后继续通入二氧化碳,过一段时间后,发现沉淀溶解变成澄清溶液。为了确定沉淀溶解成澄清溶液的原因,小组的同学进行了相关探究。
(提出问题):沉淀为什么能溶解变成澄清溶液?
(查阅资料):碳酸盐溶于酸,碳酸氢钙[Ca(HCO3)2]溶于水。
(猜想与假设):①溶液呈酸性;②反应生成了碳酸氢钙。
(实验与结论):
实验操作 | 实验现象 | 实验结论 |
实验Ⅰ:把一小片pH试纸放在一块干净的玻璃片上,用_________蘸取沉淀溶解成澄清的溶液沾在试纸上,把试纸呈现的颜色与标准比色卡对照。 | 测得被测液的pH=8 | 猜想①______________。 (填“成立”或“不成立”) |
实验Ⅱ:取沉淀溶解成澄清的溶液于另一支试管中,加入_____________________ ___________________。 | 有气体产生 | 反应的化学方程式为: _______________________________。 猜想②成立。 |
通过探究得知,生成的沉淀会与二氧化碳、水反应生成了可溶于水的碳酸氢钙。
(交流与反思):
从探究中你得到的启示或感受是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上常利用电石制乙炔气体(C2H2)时产生的灰浆和残渣制备化工原料KClO3和超细CaCO3。
电石制乙炔气体(C2H2)时产生灰浆和残渣的过程如下:
![]()
其中电石与水反应生成氢氧化钙和乙炔,该反应的化学方程式为:CaC2+2H2O=Ca(OH)2+C2H2↑ 残渣中主要成分是Ca(OH)2 和CaCO3。
Ⅰ.制备KClO3的流程如下:
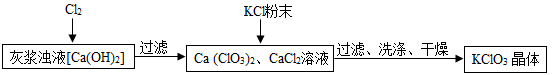
(1)向灰浆浊液中通入Cl2 ,得到Ca(ClO3)2、CaCl2溶液。反应中Ca(ClO3)2与CaCl2的化学计量数分别为1和5。写出此反应的化学方程式 。
(2)有关物质在常温下的溶解度如下:
物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
上述流程中加入KCl粉末,KCl与 (填化学式)发生了复分解反应,得到KClO3晶体。你认为能得到KClO3 晶体的原因是 。
(3)洗涤时,可以选用下列 作洗涤剂(填字母编号)。
A.KCl饱和溶液 B.冰水 C.饱和KClO3溶液
Ⅱ.制备超细CaCO3的流程如下(注:加入NH4Cl溶液的目的是溶解残渣中的难溶盐):
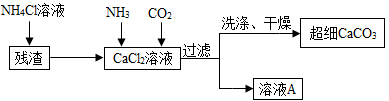
(4)流程中溶液A可循环使用,其主要成分的化学式是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小强在回家的途中经过一鱼塘边时,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡,经咨询得知,这种固体的主要成分是过氧化钙(CaO2),请你与小强共同探究。
(1)为研究鱼塘中大量气泡是何种气体所致,小强使用如下图所示的装置进行实验,打开仪器a的活塞,控制滴加水的速度,观察到试管内有气泡产生,用带火星的木条靠近P处,木条复燃,说明生成的气体是 。由此可知养鱼师傅向鱼塘中撒过氧化钙的目的是 ,仪器a的名称是 。

(2)根据质量守恒定律,小强认为过氧化钙与过量水反应还应产生某种含有钙元素的产物。开始小强假设该产物为CaO,但通过思考他很快否定了原先的假设,并重新假设生成的含钙产物为Ca(OH) 2。请解释小强否定原假设建立新假设的理由: 。
请设计一个实验方案来验证小强的新假设,并填入下表空格中:
实验步骤 | 可能出现的现象 | 结论 |
CaO2与H2O反应有Ca(OH) 2生成 | ||
CaO2与H2O反应无Ca(OH) 2 生成 |
(3)小强通过实验证明了过氧化钙与水反应的确有氢氧化钙生成,请写出过氧化钙和水反应的化学方程式: 。
(4)小强在实验时观察到烧杯中有气泡产生,由此他还得出了什么结论 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某学生用量筒取液体时,量筒平稳地放置在实验台上,使视线与凹液面的最低点保持水平,读数为18mL;倒出部分液体后,俯视凹液面的最低处,读数为12mL,则该学生实际倒出的液体体积为( )
A.肯定大于6mL B.肯定小于6mL
C.肯定等于6mL D.可能大于也可能小于6mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com