
| 3.5g |
| 10g |
| 65 |
| 6.5g |
| 98 |
| x |
| 9.8g |
| 49.0 |


科目:初中化学 来源: 题型:阅读理解

| 猜想 | 简单实验方案 | 现象 | CO和CuO反应的化学方程式 |
| 粉末为Cu | 不反应 | CuO+CO=Cu+CO2 | |
| 粉末溶解,溶液变成蓝色,生成红色粉末 | 2CuO+CO=Cu2O+CO2 |

查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 金属与人类的生活和生产密切相关.
金属与人类的生活和生产密切相关.| 实验步骤 | 现象和结论 | 有关反应的化学方程式 |
| 取少量滤纸上剩余的物质置于试管中,向其中滴加适量的 |
||
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
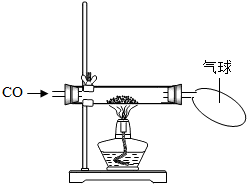
| 猜想 | 简单实验方案 | 现象 | CO和CuO反应的化学方程式 |
| 粉末为Cu | 不反应 | CuO+CO=Cu+CO2 | |
| 粉末溶解,溶液变成蓝色,生成红色粉末 | 2CuO+CO=Cu2O+CO2 |
查看答案和解析>>
科目:初中化学 来源:2009-2010学年江苏省镇江市镇江四中九年级(上)期末化学试卷(解析版) 题型:解答题

| 猜想 | 简单实验方案 | 现象 | CO和CuO反应的化学方程式 |
| 粉末为Cu | 不反应 | CuO+CO=Cu+CO2 | |
| 粉末溶解,溶液变成蓝色,生成红色粉末 | 2CuO+CO=Cu2O+CO2 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com