
【题目】现有含HCl和CuCl2的混合溶液50g,向该溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成沉淀的质量与加入NaOH溶液的质量关系如图所示.
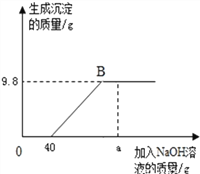
(1)求混合溶液中CuCl2的质量分数为_______________;
(2)求恰好完全反应时,所得溶液溶质质量分数为_______________;(保留一位小数)
【答案】 27% 11.0%
【解析】设混合溶液中CuCl2的质量分数为x。
2NaOH + CuCl2 ===2NaCl+ Cu(OH)2↓
135 98
50g×x 9.8g
![]() =
=![]() ,解得x=27%
,解得x=27%
(2)根据图像可知,与稀盐酸反应的氢氧化钠溶液的质量为40g,设稀盐酸与氢氧化钠反应生成氯化钠的质量为y。
NaOH + HCl == NaCl + H2O
40 58.5
40g×10% y
![]() =
=![]() ,解得y=5.85g
,解得y=5.85g
设氢氧化钠与氯化铜反应生成氯化钠的质量为z。
2NaOH + CuCl2 ===2NaCl+ Cu(OH)2↓
117 98
z 9.8g
![]() =
=![]() ,解得z=11.7g
,解得z=11.7g
设生成9.8g氢氧化铜沉淀,反应掉氢氧化钠溶液的质量为w
2NaOH + CuCl2 ===2NaCl+ Cu(OH)2↓
80 98
w×10% 9.8g
![]() =
=![]() ,解得w=80g
,解得w=80g
恰好完全反应时,所得溶液溶质的质量为:5.85g+11.7g=17.55g
恰好完全反应时,所得溶液的质量为:50g+40g+80g-9.8g=160.2g
恰好完全反应时,所得溶液的溶质质量分数为:![]() ×100%=11.0%
×100%=11.0%


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:初中化学 来源: 题型:
【题目】钛和钛合金被认为是 21 世纪的重要金属材料, 他们具有很多优良的性能, 如熔点高, 密度小, 可塑性好等。以钛铁矿 ( 主要成分为 FeTiO3 , 同时含有少量的 Fe2 O3 、FeO等) 为原料制 TiO2 , 再由 TiO2 制金属 Ti 的工艺流程如下:
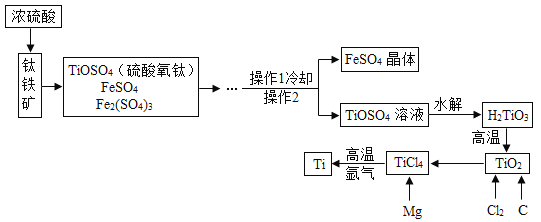
【查阅资料】钛、镁在高温下与空气中的氧气、二氧化碳等反应。
(1)操作 2 的名称是_________ 。
(2)工艺流程中, 水解属于________ 变化。
(3)工业上常在高温和氩气氛围中, 用金属镁和 TiCl4 反应的方法制备 Ti, 氩气的作用是__________ 。
(4)TiO2 可与焦炭、氯气在高温下反应, 生成TiCl4和一氧化碳, 该反应的化学方程式为_________ 。
(5)写出钛合金的一种用途_________ 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了达到相应的实验目的,下列实验设计部不合理的是
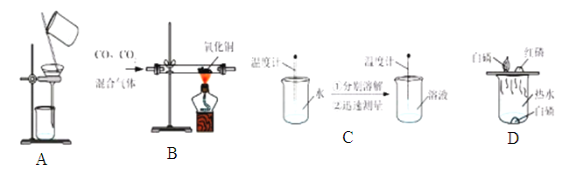
A.分离H2O2和MnO2制O2后的固液混合物 B.除去CO中的CO2气体
C.区分NaCl、NH4NO3、NaOH三种固体 D.探究可燃物燃烧的条件
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国拥有丰富的海洋资源,我们可以从海水中提取食盐,并以此为原料制得具有广泛用途的产品。
(1)海水晒盐是利用了_____的方法使食盐晶体析出,得到粗盐。
(2)某制碱工厂以粗盐为原料制纯碱,部分工艺流程如下: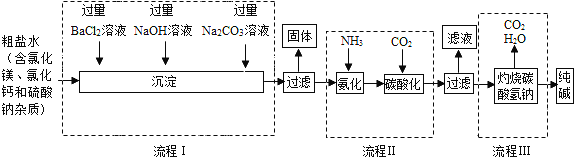
①流程I中为了除去杂质,依次加入过量BaCl2溶液、NaOH溶液和Na2CO3溶液,下列说法正确的是_____(填字母编号);
A.加入三种溶液的顺序不能调整
B.加入三种溶液可将粗盐水中的SO4、Mg2+、Ca2+转化为沉淀
C.按流程I所加溶液的顺序除杂,过滤后得到四种沉淀
②在流程I中,加入氢氧化钠溶液时发生反应的化学方程式是_____;
③流程I中Na2CO3溶液的作用是_____;
④写出流程Ⅲ中发生反应的化学方程式_____。
(3)将已配制好的100g质量分数为6%的氧化钠溶液变成质量分数为20%的氯化钠溶液,需要再加入NaCl的质量是_____g。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学小组参观制碱厂后,绘制了该厂生产纯碱的工艺流程图如下,据图回答:
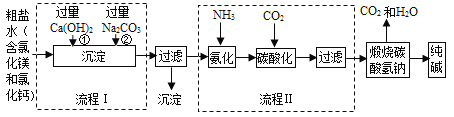
(1)流程图Ⅰ是依次向粗盐水中加入Ca(OH)2和Na2CO3,二者加入的顺序能否颠倒?______(填“能或否”),为什么___________________。
(2)过滤I得到的沉淀成分有:______________和______________(填化学式)
(3)如果不将氯化铵作为目标产品,即加入氨气不是为了生产出氯化铵,那么,氨气在制碱过程中的作用_______________________。
(4)流程Ⅱ发生的反应方程式为:___________________________
(5)20℃时,向100g水中加入11.7g氯化钠和15.8g碳酸氢铵,充分反应后,理论上从溶液中析出晶体的质量为_______g 。(20℃时碳酸氢钠的溶解度为9.7g,氯化铵的溶解度为37.2g)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下面短文,回答相关问题。
生活中你是否遇到过这样的事情:你将苹果去皮、切块儿,等待妈妈下班回来。可是一段时间后,苹果块儿表面会生成一种褐色的物质,口感也不那么脆了......变化其实来自于苹果中存在的一种原本无色的多酚类的物质。这类物质能跟氧气结合,产生一些有色物质,这就是褐变过程。
防止苹果发生褐变过程的方法有很多。
碳酸氢钠是一种安全、价格低廉的化学物质,能够直接抑制水果病原真菌的生长,常用于水果贮藏保鲜。选择新鲜、大小均匀、无虫害无伤的苹果果实,消毒、清洗后切成12片,每片厚度约为15mm。切片立即浸泡于下表中的碳酸氢钠溶液中进行保鲜处理。每种浓度的碳酸氢钠溶液中浸泡2块苹果切片。5分钟后将苹果切片捞出、甩干,将12片苹果装在一个塑料保鲜盒中,置于4℃贮藏观察。
1 | 2 | 3 | 4 | 5 | 6 | |
碳酸氢钠溶液的溶度g/L | 0 | 0.5 | 2.0 | 5.0 | 10.0 | 15.0 |
pH | 7.01 | 8.00 | 8.12 | 8.20 | 8.25 | 8.33 |
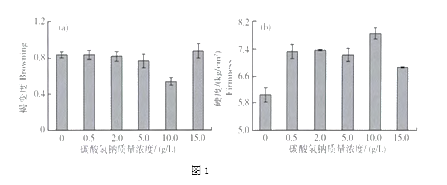
在贮藏3天后,取样测定其褐变度和硬度变化,记录的数据如下图1。
(注:褐变度表示苹果褐变的程度,数值越大褐变程度越高;硬度表示苹果的酥脆程度,数值越大说明越酥脆)
抗坏血酸(即维生素C)是一种抗氧化剂,也可以有效抑制苹果切分后褐变和变软。抗坏血酸在酸性环境下稳定,但是很难发挥抗氧化作用,在弱碱性环境下可以发挥很强的抗氧化作用。而苹果果实的pH一般在3.0~3.8。
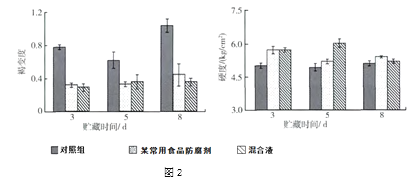
取三组苹果切片,分别用10g/L某常用食品防腐剂、10g/L碳酸氢钠与10g/L抗坏血酸的混合液、对照液(蒸馏水)处理,4℃贮存并观察,记录数据如下图2:
依据文章回答下列问题。
(1)苹果褐变的过程属于____变化(填“物理”或“化学”)。
(2)碳酸氢钠的俗称是_____(填序号)。
A.食盐 B.纯碱 C.小苏打 D.苛性钠
(3)由图1可知,用____ g/L碳酸氢钠溶液处理对鲜切苹果的褐变、变软抑制的效果更好。
(4)由实验可知:抗坏血酸溶液与碳酸氢钠溶液混用效果更好,试推测可能的原因是:_________。
(5)根据文中的实验数据,你对储存苹果切片有哪些建议_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下面是几种实验室制取气体的发生装置(A、B)和收集装置(C、D、E),洗气装置(F)。
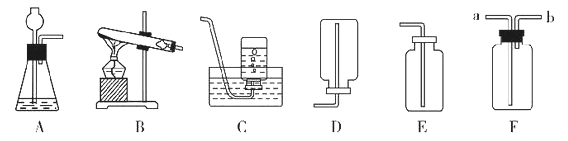
(1)实验室制取并收集二氧化碳时应选用的仪器装置________(填字母标号);检验二氧化碳是否集满的方法是:___________。
(2)上述装置中的A和C组合后,可以用来制取并收集氧气,写出实验室制取该气体的化学方程式:___。
(3)如果用F装置干燥氧气,则F装置中装入浓硫酸后,氧气应从_______(填“a”或“b”)进入F中。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据如图中A、B、C三种物质(均不含结晶水)的溶解度曲线,回答下列问题:
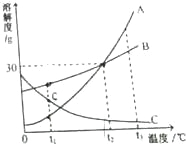
(1)t1℃时,A、B、C三种物质的溶解度由大到小的顺序是 。
(2)t2℃时,向100水中加入20A物质,充分溶解后,所得溶液是 (填“饱和”或“不饱和”)溶液。
(3)将t3℃时等质量A、B的饱和溶液分别降温至t2℃,对所得溶液的叙述正确的是 (填序号)。
①溶质质量:A>B
②溶剂质量:A<B
③溶质质量分数:A=B
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学小组发现,铜制品表面出现了绿色物质,于是想探究绿色物质产生的条件。
查阅资料:铜在空气中会生锈,铜锈为绿色物质,俗称“铜绿”,主要成分是Cu2(OH)2CO3;
【猜想】
小组同学经讨论,做出以下两个合理的猜想:
猜想一:铜生锈只与空气中的H2O和气体X有关,则气体X是________。
猜想二:铜生锈只与空气中的H2O、气体X和气体Y有关,则气体Y是_______。
上述猜想的理由是_______。
【实验】
小组同学设计并进行了右图所示的实验。
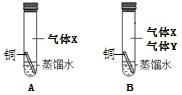
现象:一段时间后,观察到A试管中的铜丝无明显变化, B试管中的铜丝出现铜锈,多次实验均得到同样的结果。
【结论】
铜生锈的是铜与空气中的_______共同作用的结果。
【拓展】
(1)实验需使用经煮沸迅速冷却的蒸馏水,原因是_________;
(2)除去铜锈可用稀盐酸,写出铜锈与稀盐酸反应的化学方程式__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com