
【题目】钛和钛合金被认为是 21 世纪的重要金属材料, 他们具有很多优良的性能, 如熔点高, 密度小, 可塑性好等。以钛铁矿 ( 主要成分为 FeTiO3 , 同时含有少量的 Fe2 O3 、FeO等) 为原料制 TiO2 , 再由 TiO2 制金属 Ti 的工艺流程如下:
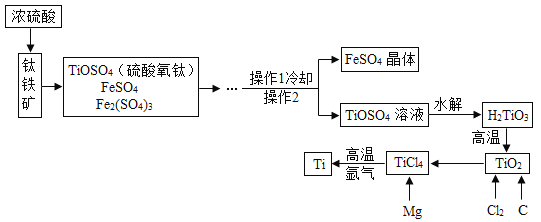
【查阅资料】钛、镁在高温下与空气中的氧气、二氧化碳等反应。
(1)操作 2 的名称是_________ 。
(2)工艺流程中, 水解属于________ 变化。
(3)工业上常在高温和氩气氛围中, 用金属镁和 TiCl4 反应的方法制备 Ti, 氩气的作用是__________ 。
(4)TiO2 可与焦炭、氯气在高温下反应, 生成TiCl4和一氧化碳, 该反应的化学方程式为_________ 。
(5)写出钛合金的一种用途_________ 。
【答案】 过滤 化学 防止钛、镁在高温下与空气中的氧气、二氧化碳等反应 TiO2+2Cl2+2C![]() TiCl4+2CO 制造人造骨
TiCl4+2CO 制造人造骨
【解析】由题中信息知, (1)操作 2 的名称是过滤,过滤是把不溶于液体的固体物质与液体分离的一种方法。(3) 氩气化学性质比较稳定,氩气的作用是防止钛、镁在高温下与空气中的氧气、二氧化碳等反应。(4)TiO2 可与焦炭、氯气在高温下反应, 生成TiCl4和一氧化碳, 该反应的化学方程式为TiO2+2Cl2+2C![]() TiCl4+2CO。(5)钛合金的一种用途是制造人造骨,钛和钛合金具有很多优良的性能, 如熔点高, 密度小, 可塑性好等。
TiCl4+2CO。(5)钛合金的一种用途是制造人造骨,钛和钛合金具有很多优良的性能, 如熔点高, 密度小, 可塑性好等。
点睛∶钛、镁在高温下与空气中的氧气、二氧化碳等反应。钛和钛合金具有很多优良的性能, 如熔点高, 密度小, 可塑性好等。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】徐州地区石灰石资源丰富。某化学兴趣小组称取4.0g石灰石样品,把40g稀盐酸分4次加入样品中(假设杂质不反应也不溶解),得实验数据如下:
稀盐酸的用量 | 剩余固体的质量 |
第一次加入10g | 3.0g |
第二次加入10g | 2.0g |
第三次加入10g | 1.0g |
第四次加入10g | 0.6g |
请计算:
(1)4.0g石灰石样品中碳酸钙的质量是____g。
(2)10g稀盐酸能与_____g碳酸钙正好完全反应。
(3)求稀盐酸的溶质质量分数为_________(写出计算过程,结果精确到0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】你玩过拼图吗?以下拼图分别代表Fe、CO2、H2SO4、Ca(OH)2、BaCl2、Cu (NO3)2中的一种物质,其中③是同类物质中年产量最多的一种材料,规则是能反应的物质可以邻边相接拼在一起。
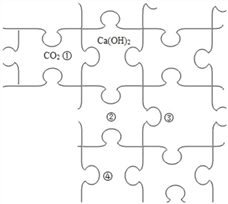
(1)H2SO4应安排在位置____________(填序号)
(2)图中CO2和相邻物质发生反应的现象为____________________。
(3)写出②和③反应的化学方程式_________________,该反应的基本类型是__________。
(4)请写出一种能放在③④夹角间空拼图处的一种无色盐溶液的溶质化学式_______________ 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室常用以下装置制取气体。
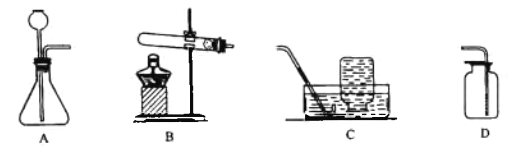
(1)用高锰酸钾制氧气的化学方程式为_____,发生装置应选择(填字母,下同)___;选择依据是___
(2)用大理石和稀盐酸制二氧化碳的化学方程式为_____,发生装置应选择___,收集二氧化碳一般用装置D而不用C的原因是____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)如图是实验室制取气体的常用装置。
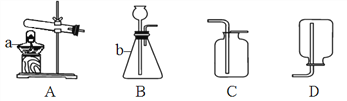
①写出图中标注仪器的名称:a__________,b___________。
②制取氧气,发生装置选用________,发生反应的化学方程式是____________。
③用B装置制取二氧化碳气体,首先往锥形瓶中加入的药品是_________,选用的收集装置是________。
(2)有同学认为这样收集到的二氧化碳气体纯度不高,他设计如图所示装置,测定瓶中二氧化碳气体的体积分数。
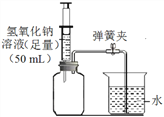
①检查该装置气密性。
②用量筒等仪器测量集气瓶的容积,其方法是:记下塞子塞入集气瓶的位置线,取下塞子,接着___________, 由此测得集气瓶的容积为260 mL。
③吹干集气瓶后集满一瓶二氧化碳气体。
④塞上塞子,将50mL氢氧化钠溶液注入集气瓶中并轻摇,发生反应的化学方程式是__________,一段时间后打开止水夹,测得集气瓶内液体体积为156 mL,该瓶气体中二氧化碳气体的体积分数是_______。
⑤根据以上探究过程,请你评价“这样收集二氧化碳气体方法”的优点和不足(各一点):_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学是一门以实验为基础的科学,回答下列课本实验的相关问题。
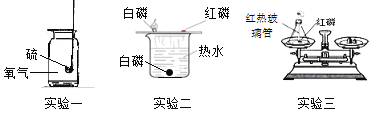
(1)实验一硫在氧气中燃烧产生___色火焰。硫燃烧实验即将结束时,使火焰迅速熄灭的操作是____。
(2)实验二的目的是_________,其中热水的作用之一是________。
(3)实验三是验证质量守恒定律的实验,其中细沙的作用是______;
用微粒的观点解释质量守恒定律,其原因是:化学反应前后原子的种类、原子数目、____不变。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】KNO3和NaCl的溶解度表及溶解度曲线如右图,下列说法错误的是 ( )
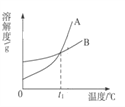
温度/℃ | 0 | 20 | 40 | 60 | 80 | |
溶解度S/g | KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 |
NaCl | 35.7 | 36 | 36.6 | 37.3 | 38.4 | |
A. t1介于20℃-40℃之间
B. 50℃时,溶液的溶质质量分数:KNO3 >NaCl
C. 当KNO3中混有少量NaCl时,可用降温结晶的方法提纯KNO3
D. 60℃时,30g KNO3加入50g水,充分溶解,再降温到20℃,会析出晶体14.2g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如图所示,下列说法正确的是( )
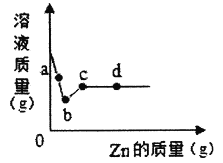
A. a点溶液中的溶质有2种
B. c点溶液中溶质为Zn(NO3) 2
C. 若取b~c段溶液,滴加稀盐酸,有白色沉淀
D. 取d点的固体,加入稀盐酸,无气泡产生
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有含HCl和CuCl2的混合溶液50g,向该溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成沉淀的质量与加入NaOH溶液的质量关系如图所示.
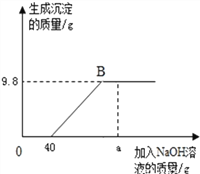
(1)求混合溶液中CuCl2的质量分数为_______________;
(2)求恰好完全反应时,所得溶液溶质质量分数为_______________;(保留一位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com