

| H2 | CO2 | SO2 | |
| 密度(g/L) | 0.08987 | 1.975 | 2.716 |
| 溶解度(g) | 0.0001603 | 0.1688 | 11.28 |
| 猜 想 | 验 证 方 法 |
| 猜想1:______ | ______ |
| 猜想2:______ | ______ |
| 猜 想 | 验 证 方 法 |
| 猜想1:与金属的活动性强弱有关 | 将形状和大小都相同的锌片和铁片,分别放入溶质质量分数和温度都相同的稀硫酸中 |
| 猜想2:与酸的溶质质量分数有关 | 将形状和大小都相同的两个锌片,分别放入温度相同但溶质质量分数不同的两种稀硫酸中 |
| 猜想3:与温度高低有关 | 将形状和大小都相同的两个铁片分别放入相同溶质质量分数的稀硫酸中,一个加热,另一个不加热 |


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:初中化学 来源: 题型:阅读理解
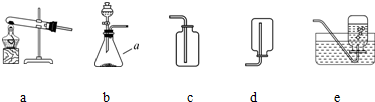
| 二氧化锰 |
| 二氧化锰 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| H2 | CO2 | SO2 | |
| 密度(g/L) | 0.08987 | 1.975 | 2.716 |
| 溶解度(g) | 0.0001603 | 0.1688 | 11.28 |
| 猜 想 | 验 证 方 法 |
| 猜想1: 与金属的活动性强弱有关 与金属的活动性强弱有关 |
将形状和大小都相同的锌片和铁片,分别放入溶质质量分数和温度都相同的稀硫酸中 将形状和大小都相同的锌片和铁片,分别放入溶质质量分数和温度都相同的稀硫酸中 |
| 猜想2: 与酸的溶质质量分数有关 与酸的溶质质量分数有关 |
将形状和大小都相同的两个锌片,分别放入温度相同但溶质质量分数不同的两种稀硫酸中 将形状和大小都相同的两个锌片,分别放入温度相同但溶质质量分数不同的两种稀硫酸中 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
| H2 | CO2 | SO2 | |
| 密度(g/L) | 0.08987 | 1.975 | 2.716 |
| 溶解度(g) | 0.0001603 | 0.1688 | 11.28 |
| 猜 想 | 验 证 方 法 |
| 猜想1:______ | ______ |
| 猜想2:______ | ______ |
查看答案和解析>>
科目:初中化学 来源: 题型:
实验室采用右图所示装置制取和收集的气体必须满足的条件是:
在我们已学习过的内容中,有两种气体可以在实验室采用该装置进行制取,请写出这两个制备反应的化学方程式:
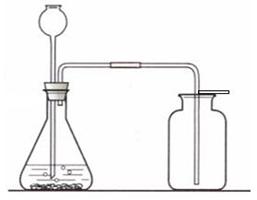
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com