
科目:初中化学 来源: 题型:选择题
| A. | 生成气体的质量可能是11克或33克 | |
| B. | 滤渣中的红色物质可能是32克或96克 | |
| C. | 参与反应的氧化铜质量可能是40克或120克 | |
| D. | 稀硫酸的溶质质量可能是38.4克或115.2克 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
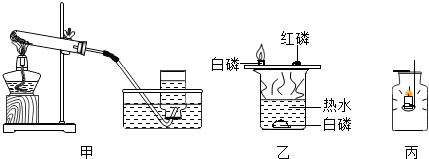
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 有机合成材料都是高分子材料 | |
| B. | 焚烧聚乙烯塑料会造成环境污染 | |
| C. | 使用过的塑料、橡胶应回收利用 | |
| D. | 棉花、羊毛、聚乙烯、橡胶都是合成材料 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | FeCl3 NaOH HCl | B. | BaCl2 Na2CO3 HCl | ||
| C. | HCl Na2CO3 KNO3 | D. | CuSO4 BaCl2 HNO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| 物质 | 杂质 | 检验或除去的方法 | |
| A | NaCl | Na2CO3 | 用适量的硝酸钙除杂 |
| B | CaCO3 | CaO | 用无色的酚酞试液检验 |
| C | H2 | CO2 | 通过盛有氢氧化钠溶液的洗气瓶除杂 |
| D | CuO | Fe | 用稀硫酸除杂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 甲 | 乙 | 丙 | |
| 烧杯+稀硫酸的质量 | 200 | 150 | 150 |
| 加入铁的样品的质量 | 9 | 9 | 14 |
| 充分反应后,烧杯+剩余物的质量 | 208.7 | 158.7 | 163.7 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
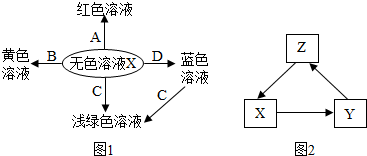
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com