
【题目】三氧化二铬(Cr2O3)可用作油漆颜料,Cr2O3中Cr的化合价是( )
A.﹣3
B.﹣2
C.+2
D.+3
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:初中化学 来源: 题型:
【题目】研究性学习小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行研究,以下是他们探究的主要过程: 【假设】H2O2生成O2的快慢与催化剂种类有关
【实验方案】常温下,在两瓶相同体积的H2O2溶液中分别加入相同质量MnO2和红砖粉,测量各生成一瓶(相同体积)O2所需要的时间.
(1)【进行实验】如图是他们进行实验的装置图,气体发生装置中A仪器名称是: , 此实验中B处宜采用的气体收集方法是: . 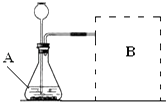
(2)【实验记录】
实验编号 | 1 | 2 |
反应物 | 6% H2O2 | 6% H2O2 |
催化剂 | 1g红砖粉 | 1g MnO2 |
时间 | 152s | 35s |
【结论】该探究过程得出的结论是 .
(3)【反思】H2O2在常温下分解缓慢,加入MnO2或红砖粉后反应明显加快,若要证明MnO2或红砖粉是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的和是否改变. H2O2生成O2的快慢还与哪些因素有关?请你帮助他们继续探究.(只要求提出假设和实验方案)
(4)【假设】 .
(5)【实验方案】 . 你若还能提出新的合理的假设和实验方案
(6)【假设】 .
(7)【实验方案】 .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图1是“燃烧的条件”实验活动的部分操作示意图: 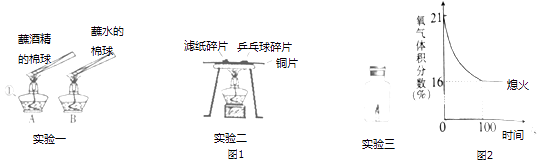
(1)仪器①的名称为;
(2)实验一加热片刻观察到A中棉球上的酒精燃烧产生蓝色火焰,B中棉球上的水不燃烧,由此得出燃烧的条件之一是;
(3)实验二观察到先燃烧的物质是;若将铜片上的物质换成等量的木屑和煤粉进行实验,观察到木屑先燃烧,说明木屑的着火点比煤粉;
(4)实验三将燃着的蜡烛放在如图2所示的密闭容器中,同时用氧气传感器侧出密闭容器中氧气含量的变化如右图所示,下列说法错误的是(填序号).
A.蜡烛燃烧需要氧气
B.蜡烛燃烧前,密闭容器中氧气的体积分数为21%
C.蜡烛熄灭后,密闭容器中还有氧气
D.蜡烛熄灭后,密闭容器中的二氧化碳体积分数为84%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碱式碳酸镁是一种新型阻燃剂,其工业制备流程如下: 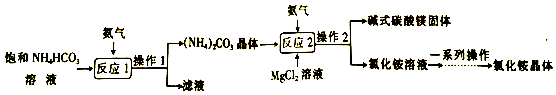
(1)常温下向溶液中加入少量的NH4HCO3固体,固体不能溶解,则该溶液为NH4HCO3的(填“饱和”或“不饱和”)溶液;
(2)操作I的名称是;“一系列操作”中包括蒸发,实验室中蒸发溶液时用玻璃棒搅拌的作用是;
(3)副产品氯化铵与氢氧化钠反应,生成了一种可直接进入上述流程循环利用的物质是 .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知过氧化钠(化学式为Na2O2)是一种浅黄色固体粉末,可用作呼吸面具里的供氧剂,利用人呼出的二氧化碳与Na2O2反应放出O2 , 供给人的正常生命活动,该反应的化学方程式为:2Na2O2+2CO2═2Na2CO3+O2 . 某同学利用该反应原理制取氧气,设计了如图一所示的实验装置. 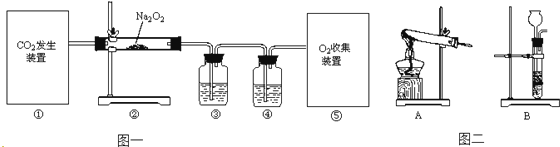
(1)装置①中CO2的制取方法有多种,若用稀盐酸和石灰石制取CO2 , 该反应的化学方程式为 . 若用加热NaHCO3固体制取CO2 , 应该选用的发生装置为(选填图二中字母,下同).
(2)为收集纯净干燥的O2 , 装置③中盛放的试剂为;装置④中盛放的试剂作用是;则⑤中收集方法可选用 .
A.排水集气法 B.向下排空气法 C.向上排空气法 D.真空袋收集法
(3)当观察到装置②中时应停止通CO2 .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面.某兴趣小组同学对其进行探究.一过氧化钙的性质研究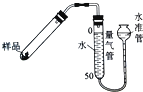
(1)取少量过氧化钙放入试管中,加足量水,产生无色气泡,将带火星的木条伸进试管中,观察到带火星的木条 , 说明过氧化钙与水反应有氧气生成.
(2)分别取实验(1)静置后的上层清液少量于两支试管中,向其中一支试管中滴入酚酞试液,发现溶液变成红色,说明溶液呈性;向另一支试管中通入二氧化碳,溶液变浑浊,说明过氧化钙与水反应还有氢氧化钙生成.
结论:过氧化钙和水反应生成氢氧化钙和氧气.
(3)二过氧化钙的制备研究
实验室用钙盐制备CaO2 , 其主要实验装置(图1)和流程(图2)如下: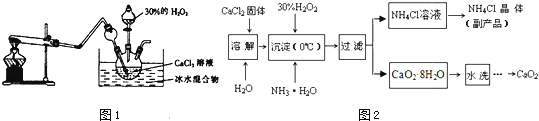
图1试管中的物质是NH4Cl和Ca(OH)2 , 加热时发生反应生成CaCl2、NH3 和H2O,反应的化学方程式为 .
(4)“沉淀”时发生的反应为:CaCl2+H2O2+2NH3H2O+6H2O=CaO28H2O↓+2NH4Cl,需要控制温度在0℃左右,采用的操作是将反应容器放置在中,反应温度不能过高的原因是:①防止氨水挥发;②
(5)“过滤”所得的副产品NH4Cl可做化肥中的氮肥.检验“水洗”已经洗净的方法是:取最后一次洗涤液少量于试管中, .
(6)加热分解法是测定CaO2产品纯度的常用方法之一(2CaO2![]() 2CaO+O2↑).
2CaO+O2↑).
如图是实验室测定产品中CaO2纯度的装置.实验步骤:检查装置的气密性→装填药品0.30g→调节量气管和水准管两边水位相平→加热至不再有气体放出→冷却至室温,调节量气管和水准管两边水位相平→读数→再重复2次,取平均值,计算.(已知:该温度和压强下的O2密度为1.43g/L)
根据下表数据,计算CaO2产品纯度(请写出计算过程).
组别 | 样品质量 | V(O2)/mL |
第一组 | 0.30 | 28.2 |
第二组 | 0.30 | 28.0 |
第三组 | 0.30 | 27.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com