
已知在pH为4~5的环境中,Cu2+几乎不水解,而Fe3+已完全水解,转化为Fe(OH)3。某同学欲提纯含有少量Fe2(SO4)3和稀H2SO4的CuSO4溶液,并利用电解纯净的CuSO4溶液得到的数据,计算Cu的相对原子质量。
(1)向含有少量Fe2(SO4)3和稀H2SO4的CuSO4溶液中,加入稍过量的黑色粉末A搅拌、过滤,得到较纯净的CuSO4溶液。A的化学式为___________,加入A的作用是___________________________________________________________;
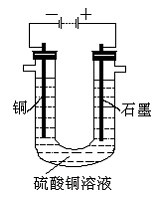
(2)将较纯净的CuSO4溶液放入右图所示的装置中进行电解,
石墨电极上的电极反应式为_________________________________________,
电解反应的离子方程式为___________________________________________;
(3)实验完成后,石墨电极产生标准状况下的气体V mL,铜电极增重ag,则
Cu的相对原子质量(用带有a、V的计算式表示)为_______________________。
 应用题作业本系列答案
应用题作业本系列答案科目:初中化学 来源: 题型:
 利用中和反应可以测定酸或碱溶液中溶质的质量分数.例如,在一定量的待测酸(或
利用中和反应可以测定酸或碱溶液中溶质的质量分数.例如,在一定量的待测酸(或查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 (2011?扬州)某学习小组对硫酸进行如下研究:
(2011?扬州)某学习小组对硫酸进行如下研究:| 时间/h | 1 | 1.5 | 4 | 8 | 12 | 24 | 48 | 60 | |
| 吸水质量/g | 浓硫酸 | 1.6 | 2.2 | 6.2 | 10.3 | 14.0 | 20.9 | 29.2 | 32.1 |
| 稀硫酸 | 1.2 | 1.5 | 3.5 | 5.9 | 8.1 | 12.9 | 19.5 | 21.0 | |
| v×1.84g/cm3×98% |
| v×1.84g/cm3+v×1g/cm3 |
| v×1.84g/cm3×98% |
| v×1.84g/cm3+v×1g/cm3 |
查看答案和解析>>
科目:初中化学 来源: 题型:
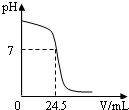
 (2010?白下区一模)利用中和反应可以测定酸(或碱)溶液的溶质质量分数.例如,在一定质量的待测酸溶液中逐滴滴入已知溶质质量分数的碱溶液,直到酸、碱恰好完全反应,根据消耗碱溶液的质量即可计算出待测酸溶液的溶质质量分数.反之亦然.右图为某次测定过程中,溶液的pH随所滴加溶液质量的变化而变化的关系图.请根据图中信息,解答下列问题.
(2010?白下区一模)利用中和反应可以测定酸(或碱)溶液的溶质质量分数.例如,在一定质量的待测酸溶液中逐滴滴入已知溶质质量分数的碱溶液,直到酸、碱恰好完全反应,根据消耗碱溶液的质量即可计算出待测酸溶液的溶质质量分数.反之亦然.右图为某次测定过程中,溶液的pH随所滴加溶液质量的变化而变化的关系图.请根据图中信息,解答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com