
【题目】绿矾(FeSO47H2O)是硫酸法生产太白粉的主要副产物,可用于制备Fe2O3 , 复印用Fe3O4粉、还原铁粉等,开发利用绿矾工艺是一项十分有意义的工作.某研究性小组展开了系列研究. Ⅰ制备Fe2O3
【资料一】
①无水硫酸铜遇水变成蓝色的硫酸铜晶体.
②绿矾(FeSO47H2O)高温分解产生一种金属氧化物和几种气态非金属氧化物.
③SO2是无色有窒息性臭味的有毒气体,能使品红溶液褪色.
甲同学用如下装置制备Fe2O3并验证绿矾受热分解的其他产物;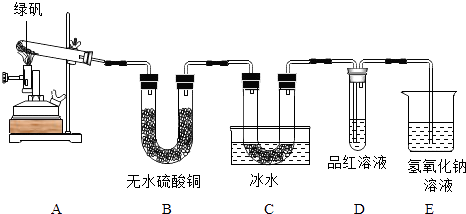
(1)实验过程中发现:A中有色固体生成,B中无水硫酸铜变蓝,C中U形管内有无色晶体(SO3)析出,D中品红溶液褪色,装置E的作用是 , 绿矾高温分解的化学方程式为 .
(2)Ⅱ制备Fe3O4 乙同学模拟生产复印用Fe3O4粉的实验流程如下:
【资料二】Fe(OH)2是一种白色难溶于水的固体,在空气中易被氧化.
FeSO4溶液中加入NaOH溶液,反应的化学方程式依次为① , ②4Fe(OH)2+O2+2H2O═4Fe(OH)3 . 由沉淀a获得Fe3O4的化学方程式为:Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O
若制取Fe(OH)2 , 采取的实验操作是:向盛有5mL新制FeSO4溶液的试管中加入10滴植物油,然后用胶头滴管加煮沸的NaOH溶液(驱赶O2),胶头滴管的争取使用方法是(填字母).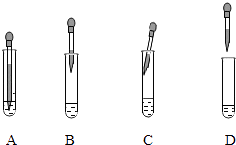
(3)Ⅲ制备还原铁粉 制备还原铁粉的工业流程如下: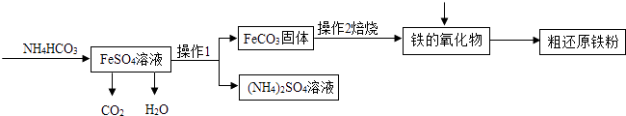
①操作1的名称是 , NH4HCO3和FeSO4溶液反应的化学方程式为 .
②若将14.06g粗还原铁粉(假设粗还原铁粉中杂质仅含少量FexC)在氧气流中完全反应,得到0.22g
CO2 , 将相同质量的粗还原铁粉与足量稀硫酸反应,得到0.48gH2(FexC与稀硫酸反应不产生H2).试通过计算确定FexC的化学式(请写出计算过程) .
③粗还原铁粉经加工处理后变成纯还原铁粉,纯还原铁粉和水蒸气在高温条件下也可制得四氧化三铁,同时生成一种气体.其装置如图所示: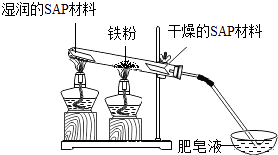
SAP材料吸水性强,湿润的SAP材料能为该反应持续提供水蒸气.实验开始一段时间后,观察到在肥皂液中有大量的气泡产生,此气泡用火柴即能点燃,同时有肥皂泡飘到空中.生成的气体是 , 干燥的SAP材料作用是 .
【答案】
(1)红棕;吸收二氧化硫,防止污染空气;2FeSO4?7H2O ![]() Fe2O3+SO2↑+SO3↑+14H2O↑
Fe2O3+SO2↑+SO3↑+14H2O↑
(2)FeSO4+2NaOH═Fe(OH)2↓+Na2SO4;A
(3)过滤;FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+CO2↑+H2O;Fe2C;氢气;干燥剂
【解析】解:【资料一】绿矾(FeSO47H2O)高温分解产生一种金属氧化物和几种气态非金属氧化物,由题意,会生成氧化铁,故会观察到A中有红棕色固体生成. 结晶水合物失去结晶水有水生成,无水硫酸铜遇水变成蓝色的硫酸铜晶体,故B中无水硫酸铜变蓝;C中U形管内有无色晶体(SO3)析出,D中品红溶液褪色,说明有二氧化硫气体生成,SO2是无色有窒息性臭味的有毒气体,故装置E的作用是吸收二氧化硫,防止污染空气.
绿矾高温分解的化学方程式为2FeSO47H2O ![]() Fe2O3+SO2↑+SO3↑+14H2O↑.【资料二】
Fe2O3+SO2↑+SO3↑+14H2O↑.【资料二】
在FeSO4溶液中加入NaOH溶液后,会发生反应:FeSO4+2NaOH═Fe(OH)2↓+Na2SO4 , 生成白色的Fe(OH)2沉淀;白色的Fe(OH)2 极易被氧气氧化,先迅速变为灰绿色,最终变为红褐色的Fe(OH)3 , 反应:4 Fe(OH)2+O2 +2H2O═4 Fe(OH)3 ,
若制取Fe(OH)2 , 采取的实验操作是:向盛有5mL新制FeSO4溶液的试管中加入10滴植物油,然后用胶头滴管加煮沸的NaOH溶液(驱赶O2),胶头滴管的争取使用方法是A;
Ⅲ制备还原铁粉(1)操作1的名称是过滤;硫酸亚铁和碳酸氢铵反应生成碳酸铁、硫酸铵、水和二氧化碳,化学方程式为:FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+CO2↑+H2O;(2)若将14.06g还原铁粉(含少量FexC)在氧气流中加热,得到0.22gCO2 , 碳元素的质量=0.22g× ![]() =0.06g
=0.06g
将相同质量的还原铁粉与足量硫酸反应,得到0.48gH2 , 依据反应方程式计算:设消耗铁的质量为x
Fe+H2SO4=FeSO4+ | H2↑, |
56 | 2 |
x | 0.48g |
![]() =
= ![]()
x=13.44g
FexC的质量=14.06g﹣13.44g=0.62g;
FexC的中铁元素的质量=0.62g﹣0.06g=0.56g
则:56x:12=0.56g:0.06g
x=2
所以化学式为Fe2C;(3)SAP材料吸水性强,湿润的SAP材料能为该反应持续提供水蒸气.实验开始一段时间后,观察到在肥皂液中有大量的气泡产生,此气泡用火柴即能点燃,同时有肥皂泡飘到空中.生成的气体是氢气,干燥的SAP材料作用是干燥剂作用.
所以答案是:
【资料一】红棕;吸收二氧化硫,防止污染空气;2FeSO47H2O ![]() Fe2O3+SO2↑+SO3↑+14H2O↑.
Fe2O3+SO2↑+SO3↑+14H2O↑.
【资料二】FeSO4+2NaOH═Fe(OH)2↓+Na2SO4 , D;
Ⅲ制备还原铁粉(1)过滤;FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+CO2↑+H2O;(2)Fe2C;(3)氢气;干燥剂作用.
【考点精析】利用书写化学方程式、文字表达式、电离方程式对题目进行判断即可得到答案,需要熟知注意:a、配平 b、条件 c、箭号.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:初中化学 来源: 题型:
【题目】如图所示,在电解水的实验中,通电一段时间后,若A试管中收集到了10mL的气体,则B试管中应同时收集到mL的气体. 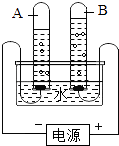
①A试管中产生的气体是 , B试管中产生的气体是 , 由此证明电解水时发生了变化,该变化的文字表达式为 , 基本反应类型是 .
②已知化学变化前后元素种类不变,那么由此实验可得出水是由组成的.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有H、C、O、S、Cu、Ca六种元素,请从中选择适当的元素组成符合要求的物质,并按要求填空:
(1)甲为碳不充分燃烧的生成物,写出甲物质的化学式;
(2)乙为最简单的有机物,写出乙物质在空气中燃烧的化学方程式;
(3)丙的水溶液为蓝色,写出丙物质溶于水解离出的阴离子的离子符号;
(4)丁为生石灰的主要成分,标出丁物质中显正价元素的化合价 .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】低血糖患者每天应注意摄入一定量的淀粉等化合物,以维持血液中的葡萄糖浓度一定。食用下列食品,可以较好地预防低血糖的是 ( )
①大米饭 ②花生仁 ③土豆片 ④玉米粥 ⑤鲜牛奶
A. ①②⑤ B. ①③④ C. ②③④ D. ①③④⑤
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】NH4Cl和NaCl的溶解度随温度变化如图所示,下列说法正确的是( ) 
A.NH4Cl的溶解度一定大于NaCl
B.将NaCl溶液降温一定会有NaCl固体析出
C.50℃时饱和溶液的溶质质量分数为50%
D.将t℃时,NH4Cl和NaCl的饱和溶液加热至50℃,两溶液的溶质质量分数相等
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为验证水的组成元素及探究水在电极端所发生的变化,兴趣小组用如图1所示装置(夹持仪器省略)进行实验: 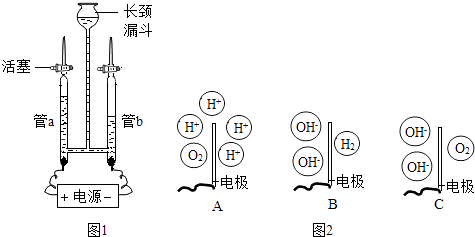
Ⅰ.验证水的组成元素
步骤一:向长颈漏斗中加水(含少量Na2SO4)至充满管a和管b.关闭活塞,接通电源,一段时间后关闭电源.
步骤二:检验管中气体.
(1)Na2SO4在水中能解离出 , 增强了水的导电性;
(2)电解时观察到的现象有:;
(3)用燃着的木条分别置于玻璃管尖嘴口,打开活塞,若观察到 , 则证明气体为H2;若观察到 , 则证明气体为O2 .
(4)某同学提出实验后还需检验Na2SO4的质量是否发生变化,其原因是 .
(5)若要确定水中氢、氧元素的原子个数比,需要测定 .
(6)Ⅱ.探究水在电极端所发生的变化 步骤一:向装置中重新加水(含少量Na2SO4)至充满管a和管b,保持活塞打开,接通电源,一段时间后关闭电源.
步骤二:分别取出管a和管b电极附近的溶液,并测定溶液的pH.
①测定溶液pH的方法是:用玻璃棒蘸取溶液,滴到pH试纸上,把试纸显示的颜色与 , 读取pH.经测定:管a中溶液pH小于7,管b中溶液液pH大于7.
②管b溶液呈性,若向溶液中加入 , 溶液变为红色,也能得出此结论.
③图2中能表示电解时管a中水在电极端所发生变化的结果的是(填对应选项的字母).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com