

分析 (1)根据化合物中各元素的质量比等于其相对原子质量之和的比进行解答;
(2)根据沉淀氢氧化铜的质量求出氯化铜的质量即可;
(3)根据氢氧化钠溶液先和盐酸反应,当盐酸反应完毕后,氢氧化钠溶液再和氯化铜溶液反应生成氢氧化铜的沉淀进行解答.
解答 解:(1)NaOH中氧元素和氢元素的质量之比=16:1;NaOH的相对分子质量=23+16+1=40;故填:16:1;40;
(2)设原混合溶液中氯化铜的质量为x,氯化铜消耗氢氧化钠溶液的质量为y.
CuCl2 +2NaOH=Cu(OH)2↓+2NaCl
135 80 98
x y×10% 9.8g
$\frac{135}{x}=\frac{98}{9.8g}$
x=13.5g
$\frac{80}{y×10%}=\frac{98}{9.8g}$
y=80g
答:原混合溶液中氯化铜的质量为13.5g;
(3)盐酸消耗的氢氧化钠溶液的质量为z.
HCl+NaOH=2NaCl+H2O
36.5 40
3.65g z×10%
$\frac{36.5}{3.65g}=\frac{40}{z×10%}$
z=40g
所以当恰好完全反应时消耗氢氧化钠溶液的质量=40g+80g=120g,生成沉淀的质量为9.8g.
生成沉淀质量与氢氧化钠溶液质量的关系图为: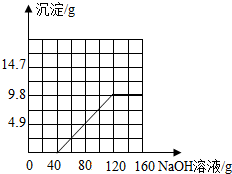
故填: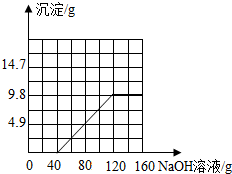
点评 本题难度较大,在计算样品完全反应时,消耗氢氧化钠溶液的质量时,一定要注意有两部分.


 天天向上口算本系列答案
天天向上口算本系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 若是镁铝合金,则m>0.2g | |
| B. | 若是镁锌合金,则m<0.2g | |
| C. | 若是镁铜合金,则稀盐酸溶质的质量分数小于7.3% | |
| D. | 若是镁铁合金,m=0.16g,则合金中铁的质量分数是50% |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验编号 | 实验药品 | 分解温度(℃) |
| ① | 氯酸钾 | 580 |
| ② | 氯酸钾、二氧化锰(质量比1:1) | 未测 |
| ③ | 氯酸钾、氧化铜(质量比l:1) | 370 |
| ④ | 氯酸钾、氧化铁(质量比1:1) | 390 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com