
����Ŀ��СǿͬѧҪ��ʵ��������15%���Ȼ�����Һ50g��
��1����֪��ˮ���ܶ�Ϊ1.0g/mL����������Ҫ��ȡ�Ȼ���7.5g����Ҫ��ȡˮ_____��
��2������⣬��������Һ��������������ƫС����ԭ�������_____������ţ���
���Ȼ��ƹ��岻�� �ڳ���ʱ�����������������ͬ��ֽƬ
����ȡˮʱ�����Ӷ��� ��װƿʱ����������Һ����
��3����ͬѧ����ͼ��ʾ�������β�����

���в�������IJ�����_____������ĸ��������ͼA�����������Ϊ5g������Ϊ2.5g����С���Ƶõ��Ȼ�������ʵ��Ϊ_____�ˣ�
���𰸡�42.5Ml �٢ڢ� AB�� 2.5
��������
��1������50g��������Ϊ15%���Ȼ�����Һ����Ҫˮ������Ϊ50g��7.5g��42.5g����42.5mL������ȡ42.5mLˮ��
��2�����Ȼ��ƹ��岻��ʱ����ʹ�Ȼ��Ƶ�������С���Ӷ�����������������ƫС��
�ڳ���ʱ�����������������ͬ��ֽƬ����ʹ�Ȼ��Ƶ�������С���Ӷ�����������������ƫС��
����ȡˮʱ�����Ӷ�������ʹ��ȡ��ˮ�����ƫ�Ӷ�����������������ƫС��
��������Һ�ľ�һ�ԣ����װƿʱ����������Һ����������������������Ӱ�죻
��3������ҩƷʱҪ�������룬��A������ȡˮʱ����Ҫƽ�Ӱ�Һ����ʹ�����B�������������Ϊ5g������Ϊ2.5g����С���Ƶõ��Ȼ�������ʵ��Ϊ5g��2.5g��2.5g��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�������Dz���Ԫ��ԭ�ӻ����ӵĽṹʾ��ͼ��������ϸ�۲졢������Ȼ��ش����⣺

���������У�����ͬһ��Ԫ�ص���_____������ţ���ͬ�������������ӵ���_____���Ӳ�����ͬ������������Ҳ��ͬ��������_____
��2����ͼ�DZ�ʾij������ӵ�ʾ��ͼ��ͼ����������O���ֱ��ʾ���ֲ�ͬ��������ԭ�ӣ����б�ʾ���������_____

��3���������þ��þԪ�صĻ��ϼ�_____����þ��þԪ������Ԫ�ص�������_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��̽����ѧ��Ӧǰ�����ʵ��������Ƿ����ı䣬��ͬѧ����ͬѧ�ֱ��������������ʵ�飬��ش�������⣺
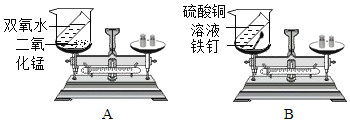
��1����ͬѧ��Ƶ�ʵ����ͼA��ʾ����Ӧǰ��������ƽ��ָ��ָ��̶��̵��м��������ʷ�Ӧ��������ƽ___________������������������������������ƫת��ԭ����____________________________________________��
��2����ͬѧ��Ƶ�ʵ����ͼB��ʾ��ͨ��ʵ��ó����ۣ���ѧ��Ӧǰ�����ʵ�������____________________________________________��
��3����λͬѧͨ��������˼�õ���ʾ����̽����ѧ��Ӧǰ�����ʵ��������Ƿ����ı�ʱ������������μӻ����������ɵķ�Ӧһ��Ҫ��___________װ���н��С�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԭ�������ڳ�ʪ�Ŀ������������⣮����m1 g�����������Ʒ��ij��ȤС��ͬѧ����Һͼ��ʾװ�ý���ʵ�飬�ⶨ����Ʒ�����������������������ⰴ��������������
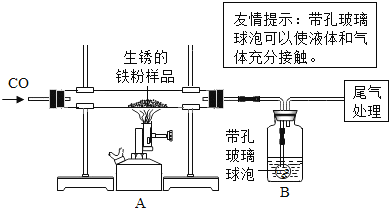
��1��װ��A�з�Ӧ�Ļ�ѧ����ʽ��_____��
��2��ijͬѧ��ͨ��Bװ�÷�Ӧǰ��������仯���ⶨ����Ʒ��������������������B�е�����Լ���_____������ţ���ʵ��ʱB�з�Ӧ�Ļ�ѧ����ʽ��_____��
�ٳ���ʯ��ˮ ����������Ũ��Һ ��ϡ���� ��ˮ
��3������ʵ������У�CO�������Ϊ��Ӧ���⣬�����������ǣ���ʵ�鿪ʼʱ���ž�װ���еĿ�������ֹ����ʱ������ը����ֹͣ���Ⱥ�ֹA�������ﱻ������B�е���Һ������A�У���_____��
��4����ȫ��Ӧ��ͬѧ�Ƶ����۵�����Ϊm2 g��ͬʱ���װ��B����m3 g����������Ʒ������������������Ϊ_____��
��5������˵˵β���Ĵ�������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��Ԫ�����ڱ��е�һ������Ӹ�ͼ��ȡ����Ϣ�У���ȷ���ǣ�������

A. ��Ԫ�ص�ԭ������Ϊ52
B. ��Ԫ�����ڷǽ���Ԫ��
C. ��Ԫ�����ԭ����Ϊ52g
D. ��Ԫ�ص�ԭ�Ӻ�����24������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���ڷ��ӡ�ԭ�ӵIJ�����о����ʵ����ʡ���ɡ��ṹ��仯���ɵĿ�ѧ����ͼ��ij��ѧ��Ӧ����ʾ��ͼ������˵����ȷ����
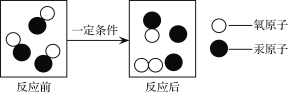
A. ��Ӧǰ����ӵĸ������� B. ������������
C. ��Ӧǰ��ԭ�Ӻ���ԭ�ӵĸ������� D. ![]() �DZ���������ѧ���ʵ���С����
�DZ���������ѧ���ʵ���С����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ɱ����ᣨC3H7NO2���ȶ��ְ����ṹ�ɵġ������ڰ���Ļ�ѧʽ���㣺
��1����������_____��Ԫ����ɣ�д��ֵ����
��2��һ������������к���_____��ԭ�ӣ�
��3�����������Է�������Ϊ_____��
��4���������е�����Ԫ�ص�������Ϊ_____��д���ȣ���
��5��178g�������к���Ԫ�ص�����Ϊ_____g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaCl����Ҫ����Դ����Ӧ������������ͼ��ʾ������˵������ȷ����

A. Ӧ�âٲ�������Ϊ�����㡢�������ܽ�
B. Ӧ�âڵõ�NaOH��ͬʱ������Cl2��H2
C. Ӧ�â�֮���Է�������Ϊһ��������NaHCO3���ܽ�Ƚ�С
D. �������ᴿ����ʱ�����μ��������BaCl2��NaOH��Na2CO3��Һ���ٹ��ˡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������г�����ͭ��Ʒ��������������ϣ�ͬѧ�����ʵ���ͭ�����������̽�����
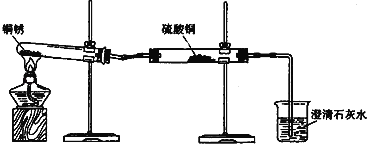
̽���һ����֤ͭ������
���������ϡ���ͭ��Ϊ��ɫ������Ҫ�ɷ���Cu2��OH��2CO3���ڰ�ɫ������ͭ��ĩ��ˮ�ܱ�Ϊ��ɫ����̼����ϡ���ᷴӦ��������ͭΪ��ɫ���壬����ϡ���ᷴӦ��������ͭ��Һ��
������ʵ��1��ͬѧ���������ͼ��ʾװ�ò�����ʵ�飮
ʵ��]�� | ʵ������ | ʵ����� |
�ٰ���ͼ��װ������װ��ҩƷ�� �ڼ���ͭ�⣬ֱ�����������������ֹͣ���ȣ� | ��ɫ�����Ϊ��ɫ������ͭ��ĩ��Ϊ��ɫ���ձ���Һ�����ǣ� | ����ͭ�����ɵ������� �� ͭ���� Ԫ����ɣ� �ձ��з�����Ӧ�Ļ�ѧ����ʽΪ �� |
����ȴ�����Թ��й��� ��������ϡ���ᣬ�Լ��ȣ� | ��ɫ�����ܽ⣬��Һ�� Ϊ��ɫ�� |
������ʵ��2��ͬѧ�ǽ����������4��ʵ�飬ÿ��۲�һ������һ��ʱ�����ֻ��ʵ��4�е�ͭ˿�����ˣ�����ˮ�Ӵ��IJ�����������ԣ�
��� | ʵ������ | ʵ����� | ʵ�鷴˼ |
ʵ��1 |
| �ڸ��ﻷ���У�ͭ�������� | ��1��ʵ��2��3��ʹ�õ��Ǿ���к�Ѹ����ȴ������ˮ����ԭ���� �� ��2�����Ҫ֤��ͭ����Ŀ����Ƿ��������̼��Ũ���йأ�����Ҫ�����һ��ʵ�������� |
ʵ��2 |
| ||
ʵ��3 |
| ||
ʵ��4 |
| ͭ�����������
|
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com