
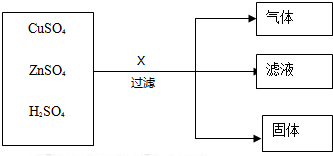
分析 (1)根据“滤液呈浅绿色”,则推测X为铁,故可推测Cu,Zn,H,X的活动性强弱;
(2)根据“若向滤出的固体中加入稀盐酸,有气泡冒出”,则说明铁过量,因为铁与ZnSO4不反应,则推测滤液中一定含有的溶质为FeSO4,ZnSO4,
解答 解:
(1)根据“滤液呈浅绿色”,则推测X为铁,故可推测Cu,Zn,H,X的活动性强弱为Zn>Fe>H>Cu;
(2)根据“若向滤出的固体中加入稀盐酸,有气泡冒出”,则说明铁过量,铁与稀盐酸溶液反应生成FeCl2和氢气.因为Zn>Fe>H>Cu,则可知铁与ZnSO4不反应,而铁与CuSO4溶液反应生成FeSO4和铜,铁与H2SO4溶液反应生成FeSO4和氢气,则推测滤液中一定含有的溶质为FeSO4,ZnSO4;
反应的化学方程式为:Fe+H2SO4=FeSO4+H2↑;Fe+CuSO4=FeSO4+Cu;
故答案为:
(1)Zn>Fe>H>Cu;
(2)FeSO4,ZnSO4;Fe+H2SO4=FeSO4+H2↑;Fe+CuSO4=FeSO4+Cu;
点评 本题难度不大,主要考查了对金属活动性顺序的应用,利用金属活动性顺序来验证金属的活动性强弱.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:初中化学 来源: 题型:解答题
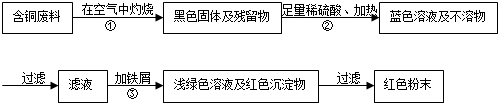
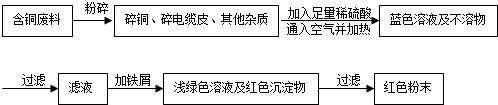
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
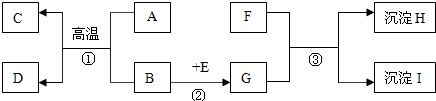
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 回忆教科书中有关“粗盐中难溶性杂质的去除”实验的主要步骤,回答有关问题:
回忆教科书中有关“粗盐中难溶性杂质的去除”实验的主要步骤,回答有关问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | m×a% g | B. | (m-w) g | C. | (m-w)×a% g | D. | ( m+w)×a% g |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | CO2和CO都可用于灭火 | |
| B. | 二者组成元素相同,化学性质也相同 | |
| C. | CO2能使澄清石灰水变浑浊 | |
| D. | CO还原氧化铁的实验中,不需要进行尾气处理 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com