
分析 (1)根据质量守恒定律来分析;
(2)水在通电的条件下分解为氢气和氧气;
(3)根据实验要求来设计实验;
(4)通过比较来分析解答.
解答 解:(1)在化学变化前后,元素的种类不变,故制取氧气的物质中必须含有氧元素;故填:质量守恒定律;
(2)水是由氢元素和氧元素组成的氧化物,属于非金属氧化物,在通电的条件下分解为氢气和氧气;故填:H2O;
(3)要想验证观点Ⅱ错误,可以加热等质量的氯酸钾、二氧化锰和高锰酸钾,观察是否能产生氧气;
故填:操作方法:分别取5g氯酸钾、二氧化锰和高锰酸钾于试管中,用酒精灯加热,并将带火星的木条放在三只试管口;
实验现象:加热一段时间后,盛放高锰酸钾的试管口处的木条复燃,证明加热高锰酸钾产生了氧气;又过一段时间后,加热氯酸钾的试管口处的木条复燃,证明加热氯酸钾也会释放出氧气;而加热二氧化锰的试管口处的木条始终没有复燃,证明加热二氧化锰没有产生氧气.
结论:观点Ⅱ是错误的.
(4)由实验比较可知,含氧化合物需要在一定的条件下才能产生氧气;故填:含氧化合物需要在一定的条件下才能产生氧气.
点评 本题考查了探究实验室中制取氧气的原理和方法,难度较大.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:选择题
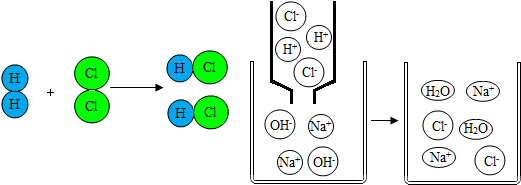
| A. | 在化学变化中物质的质量是守恒的 | |
| B. | 原子在化学变化中是可以再分的 | |
| C. | 两幅图表示的都是化合反应 | |
| D. | 以上图示中涉及的物质都属于化合物 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题



查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 序号 | 实验目的 | 实验方案 |
| ① | 证明变质 | 取少量固体,加水溶解,滴加足量稀盐酸,观察是否有气泡产生 |
| ② | 确定成分 | 取少量固体,加入石灰水,过滤,向滤液中滴加酚酞试液 |
| ③ | 测定纯度 | 取a g样品与足量氯化钡溶液充分反应,将沉淀过滤、洗涤、干燥,得到m g固体 |
| ④ | 除去杂质 | 取固体,加水溶解,滴加氯化钙溶液至恰好完全反应,过滤 |
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
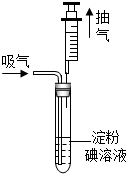 某地规定关于排放的废气中SO2的含量不超过0.4mg/L.某兴趣小组利用以下反应:SO2+I2+2H2O=H2SO4+2HI,测定某工业废气中SO2的含量,测试装置如图所示.
某地规定关于排放的废气中SO2的含量不超过0.4mg/L.某兴趣小组利用以下反应:SO2+I2+2H2O=H2SO4+2HI,测定某工业废气中SO2的含量,测试装置如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
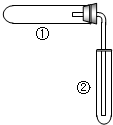 工业上,通过如下转化可制得KClO3晶体:NaCl溶液$→_{Ⅰ}^{80℃,通电}$NaClO3溶液$→_{Ⅱ}^{室温,KCl}$KClO3晶体
工业上,通过如下转化可制得KClO3晶体:NaCl溶液$→_{Ⅰ}^{80℃,通电}$NaClO3溶液$→_{Ⅱ}^{室温,KCl}$KClO3晶体| 选项 | ①中实验 | ②中现象 |
| A | 加热氯酸钾和二氧化锰的混合物 | 伸入试管内的带火星木条复燃 |
| B | 加热碱式碳酸铜固体 | 澄清石灰水变浑浊 |
| C | 加热铜丝 | 伸入水中导管口有气泡冒出 |
| D | 加热氯化铵和熟石灰的混合物 | 酚酞溶液变红 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com