
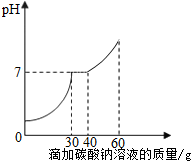
 某一盐酸溶液中含有少量氯化钙杂质,为了测定氯化钙的含量,小霞做了如下实验:取30g该盐酸溶液加入到小烧杯中,然后向小烧杯中不断滴加溶质质量分数为10.6%的碳酸钠溶液,同时用电子pH计不断读取反应时的pH,得出如右图所示的关系.求:
某一盐酸溶液中含有少量氯化钙杂质,为了测定氯化钙的含量,小霞做了如下实验:取30g该盐酸溶液加入到小烧杯中,然后向小烧杯中不断滴加溶质质量分数为10.6%的碳酸钠溶液,同时用电子pH计不断读取反应时的pH,得出如右图所示的关系.求:分析 稀盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠;
当溶液pH=7时,稀盐酸和碳酸钠恰好完全反应,根据碳酸钠溶液质量和溶质质量分数可以计算氯化氢的质量,进一步可以计算该盐酸溶液中HCl溶质质量分数;
当稀盐酸完全反应后,碳酸钠和氯化钙反应,根据反应的碳酸钠溶液质量和溶质质量分数可以计算氯化钙的质量,进一步可以计算30g该盐酸溶液中含有氯化钙的质量.
解答 解:(1)设氯化氢的质量为x,
稀盐酸和碳酸钠完全反应时,消耗碳酸钠溶液的质量是30g,碳酸钠质量为:30g×10.6%=3.18g,
Na2CO3+2HCl=2NaCl+CO2↑+H2O,
106 73
3.18g x
$\frac{106}{3.18g}$=$\frac{73}{x}$,
x=2.19g,
该盐酸溶液中HCl溶质质量分数为:$\frac{2.19g}{30g}$×100%=7.3%,
答:该盐酸溶液中HCl溶质质量分数为7.3%.
(2)设氯化钙的质量为y,
由图中数据可知,反应的碳酸钠溶液质量=40g-30g=10g,
10g碳酸钠溶液中碳酸钠质量为:10g×10.6%=1.06g,
Na2CO3+CaCl2=CaCO3↓+2NaCl,
106 111
1.06g y
$\frac{106}{1.06g}$=$\frac{111}{y}$,
y=1.11g,
答:30g该盐酸溶液中含有氯化钙的质量为1.11g.
点评 本题主要考查根据化学方程式计算的能力,同时考查了分析数据的能力,计算时要注意规范性和准确性.


科目:初中化学 来源: 题型:选择题
| A. | CO2不能燃烧也不支持燃烧 | B. | 过量排放CO2会导致温室效应 | ||
| C. | CO2中C、O原子的质量比为1:2 | D. | 在CO2中C元素的化合价为+4价 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 物质分类 | 示例:酸 | 碱 | (2)盐 | 金属氧化物 |
| 化学式 | 示例:H2SO4 | (1)Ca(OH)2 | CaSO4 | (3)CaO |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 加入过量稀盐酸除去氢氧化钠溶液中混有的少量碳酸钠 | |
| B. | 用高温煅烧的方法除去生石灰中的石灰石 | |
| C. | 加入熟石灰,然后用研磨的方法鉴别氯化钾与氯化铵固体 | |
| D. | 用水鉴别碳酸钙和氢氧化钠两种粉末状固体 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
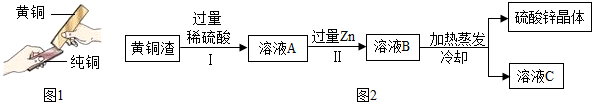
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
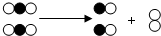 如图是表示物质间发生的一种化学反应模型示意图,图中“
如图是表示物质间发生的一种化学反应模型示意图,图中“ 、
、 ”分别表示两种不同元素的原子.该反应的类型属于( )
”分别表示两种不同元素的原子.该反应的类型属于( )| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
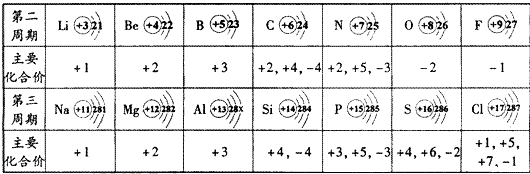
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com