
【题目】根据化学方程式不能获得的信息是
A.该反应中的反应物和生成物
B.反应发生所需要的条件
C.化学反应的快慢
D.参加反应的分子、原子的相对数目
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】(8分)某兴趣小组同学对实验室制备氧气的条件进行如下探究实验。
(1)为探究催化剂的种类对氯酸钾分解速度的影响,甲设计以下对比实验:
Ⅰ.将3.0 g KClO3与1.0 g MnO2均匀混合加热。
Ⅱ.将x g KClO3与1.0 g CuO均匀混合加热。
在相同温度下,比较两组实验产生O2的快慢。
Ⅰ中反应的化学方程式是 ;Ⅱ中x的值应为________。
(2)乙探究了影响双氧水分解速度的某种因素。反应的化学方程式为 ,有关实验数据记录如下:
双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生O2质量 | |
Ⅰ | 50.0 g | 1% | 0.1 g | 0.013 mg |
Ⅱ | 50.0 g | 2% | 0.1 g | 0.023 mg |
Ⅲ | 50.0 g | 4% | 0.1 g | 0.044 mg |
本实验中,测量O2质量应用了图的装置。根据实验装置实验所依据的原理是 。
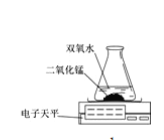
实验结论:在相同条件下,________,双氧水分解得越快。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(10分)如图为“хх”钙片商品标签图,请根据标签的有关信息完成下列各题.

该钙片主要成分碳酸钙,碳酸钙的相对分子质量为 ① .
某校化学兴趣小组为了确认标签中碳酸钙的含量是否真实,决定通过实验进行探究.
实验目标:测定该钙片主要成分碳酸钙的含量.
实验原理:取一定质量的钙片与足量的稀盐酸反应,测量生成的CO2的质量(已知该状态下CO2的密度),然后计算其中碳元素的质量,利用反应前后碳元素的质量不变,再计算出碳酸钙的质量.
实验方案:兴趣小组的同学们经过思考提出了以下几种实验方案,请你参与他们对实验方案的讨论、取舍.
方案一:甲同学设计了如图所示的装置,通过反应后右侧注射器(注射器最大量程为20mL)内收集到气体的量来进行计算.
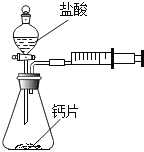
(1)同学们观看了他的设计后,都认为该方案中样品的取用的量需要一定的控制,这是因为 .
(2)同学们讨论后,一致认为注射器的摩擦会影响生成的CO2的完全收集.
方案二:乙同学设计了如图所示的装置,与甲同学的相比,仅仅在收集方法上不同.
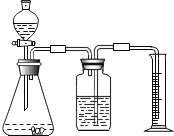
(1)同学们观看了他的设计后,都认为所测得CO2气体的体积将会 ① (填偏大或偏小),你认为他们的理由是 ② ,你的改进方案是 ③ ;广口瓶内原有的空气对实验结果 ④ (填“有”或“没有”)影响.
(2)同学们讨论后,一致认为把装置改进后测得生成的CO2气体体积会偏大,你认为他们的最主要理由是 .
方案三:丙同学设计了如图所示的装置.同学们观看后一致认可他的设计,并按照他的思路设计了以下实验步骤.
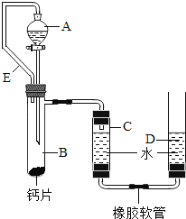
实验步骤:
①连接装置并检查装置气密性;
②加入10片钙片和水;
③记录C中液面刻度(C为带有刻度的玻璃管);
④由A向B中滴加稀盐酸至过量;
⑤待B中不再有气体产生并恢复至室温后,记录C中液面刻度,计算得到气体的体积为V mL(经查,该气体密度为ρg/L);
⑥计算气体的质量.
实验反思:
(1)丙同学在实验前将钙片全磨成粉末状,你认为他的目的是: ;
(2)检查该装置的气密性时,如图准备好装置,在C、D两管中装好水且液面相平,提高D管, ,则气密性良好;
(3)实验结论:经多次实验(钙片都是10片),所得CO2气体的平均质量是6.82g,请你最后计算确认标签中碳酸钙的含量是 (填“真实”或“不真实”)的.(最后一空不需要写计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(10分)某校化学小组对热水壶底部水垢的主要成分进行了如下探究,请完成以下活动并回答相关问题。
【查阅资料】
天然水中含有Ca2+、Mg2+、HCO3-等离子,在加热条件下,这些离子趋于生成溶解度更小的物质——水垢(主要成分为碳酸盐和碱)。有关物质的溶解性见下表(20℃):
阴离子 阳离子 | OH- | CO32- | HCO3- |
Ca2+ | 微溶 | 不溶 | 可溶 |
Mg2+ | 不溶 | 微溶 | 可溶 |
根据上述物质的溶解性,小组同学确定水垢的主要成分中一定含有的两种物质是 ,可能含有Ca(OH)2和MgCO3。
【提出问题】水垢的主要成分中是否含有Ca(OH)2和MgCO3呢?
【实验方案1】确定水垢中是否含Ca(OH)2
实验步骤 | 实验现象 | 结论 |
在少量研碎的水垢中,加入适量的蒸馏水充分搅拌,过滤,在滤液里加入Na2CO3溶液。 | _______________ | 水垢中无Ca(OH)2 |
【实验方案2】确定水垢中是否含MgCO3
利用下列实验装置,完成实验2探究。其主要实验步骤如下:
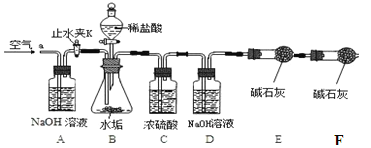
按上图组装后,将9.8g水垢试样放入锥形瓶中,打开止水夹K,从导管a处缓缓鼓入空气,一段时间后精确称量D、E装置总质量为600.0g关闭止水夹K,加入足量稀盐酸溶液,待锥形瓶中不再产生气泡时,打开止水夹K,从导管a处再次缓缓鼓入空气,一段时间后称量装置D、E的总质量为604.4g(注意:碱石灰主要成分为CaO和NaOH的混合物)。
【实验讨论】
(1)加入药品前应 ;待锥形瓶中不再产生气泡时,打开止水夹K,缓缓鼓入空气的目的是 。
(2)C装置的作用是: __ 。
(3)装置B中生成CO2的质量为 g。通过计算说明该水垢中 (填序号)含MgCO3。
A.一定 B.一定不 C.可能 D.无法确定
【实验方案3】定量探究水垢中氢氧化镁的质量分数
另取质量为9.8g的水垢试样,加入7.3%稀盐酸与之恰好完全反应,测得消耗稀盐酸110 g。结合以上数据和实验结论,计算水垢样品中氢氧化镁的质量分数(写出计算过程,结果保留1位小数)。
【反思】缺少F装置会使所测水垢样品中氢氧化镁的质量分数 _____________(填写“偏大”或“偏小”或“不变”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】一包白色粉末可能有CaCO3、K2SO4、CuSO4、BaCl2、K2CO3的一种或几种,现在进行如下实验。其中说法错误的是
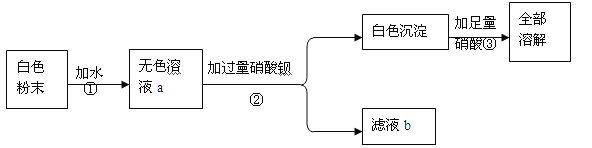
A.由操作①可知:白色粉末中一定没有CaCO3、CuSO4
B.由操作②可知:白色粉末中一定没有BaCl2
C.由操作③可知:白色粉末中一定有K2CO3可能有K2SO4
D.滤液b中的溶质有2种
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(5分)二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图,其中反应Ⅲ制取ClO2的化学方程式为2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。
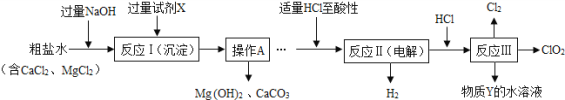
(1)试剂X是________;操作A的名称 。
(2)加入适量HCl除为了满足电解时的微酸性外,还能除去溶液中的杂质离子,请写出其中所发生的中和反应的化学方程式:________________________________。
(3)分析完成反应Ⅱ的化学方程式: _____NaCl+_____H2O![]() 。
。
(4)为提高经济效益,生产过程中除将H2和Cl2制成HCl充分利用外,还可循环使用的物质Y是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验题:(共8分)
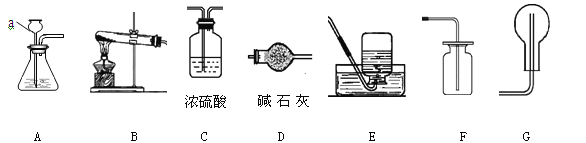
【碱石灰是氢氧化钠和氧化钙的混合物】
(1)写出图中标有字母的仪器的名称:a为____ ___。
(2)分别写出实验室用A装置制取氧气和二氧化碳的化学反应方程式 、 。
(3)氨气是一种无色、有刺激性气味的气体,极易溶于水,氨水显碱性。实验室用加热氯化铵和熟石灰两种固体的混合物来制取氨气,实验室制取、干燥、收集氨气的装置应分别选用(填序号) 、 、 。
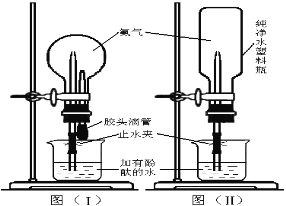
(4)按图(Ⅰ)连接,挤压胶头滴管使其少量的水进入烧瓶,打开止水夹,烧瓶中就可以看到 色的喷泉。按图(Ⅱ)连接,你怎样操作,才能引发喷泉: 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2015年12月10日,我国女科学家屠呦呦在瑞典荣获医学诺贝尔奖。她的杰出成就是创制新型抗疟疾药——青蒿素(化学式为C15H22O5),挽救了数百万人的生命。下列关于青蒿素的说法中正确的是
A.属于氧化物
B.由15个碳原子.22个氢原子和5个氧原子组成
C.分子中碳元素的质量分数最大
D.青蒿素中碳、氢、氧三种元素的质量比为15:22:5
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(5分)请根据图中a、b、c三种物质的溶解度曲线,回答下列问题:
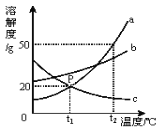
(1)P点的含义是 .
(2)t2℃时,将30g的a物质加入到50 g水中不断搅拌,能形成 g溶液.
(3)如何通过改变温度的方法将接近饱和的c溶液变成饱和溶液?
(4)将t2℃时的a、b、c三种物质的饱和溶液降温到t1℃时,溶液中溶质质量分数由大到小的顺序是 .
(5)b中混有少量a,可采用 将b提纯.(填“降温结晶”或“蒸发结晶”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com