
| A�� | ��������ݹ���������ɴ�С��˳��Ϊ��C��B��A | |
| B�� | Ϊ�������÷�Ӧ��A���÷�̪��Һָʾ��B��C�ɵμ�ϡ����ֱ�����ò�ð���� | |
| C�� | ���÷�Ӧʱ�����ɵ�������������� | |
| D�� | ���÷�Ӧʱ�������������������ȣ���Ϊ7.1g |
���� �������ƹ����������������������еĶ�����̼�ķ�Ӧ��������̼���ƺ�ˮ��̼���ƺ��������ƾ��������ᷴӦ���������ƣ��ɻ�ѧ��Ӧ�е�Ԫ���غ��֪�����������ʣ���Ԫ���������䣬�������ɵ���������������ȣ����ݻ�ѧ��Ӧ����ʽ���й���Ϣ�ɶ����ֹ������������������з�����Ҫ�жϷ�Ӧ�Ƿ�ǡ�ý��п�ͨ����Ӧ������ָʾ����ɣ�
��� �⣺A���������ƹ����������������������еĶ�����̼�ķ�Ӧ���䷴Ӧ�ķ���ʽ�ǣ�2NaOH+CO2=Na2CO3+H2O��ÿ80�ݵ��������ƿ�����106�ݵ�̼���ƣ����Ա���Խ������Խ�����ݹ���������ɴ�С��˳��Ϊ��C��B��A����ȷ��
B���������������Ʒ�Ӧ����������̪���������ʵ�����������������еμӷ�̪������μ����ᣬֻҪ��ɫǡ����ʧ��֤����������ǡ�÷�Ӧ������̼���Ƶ��������Ƽ����������������������Ʒ�Ӧ����̼���������ᷴӦ�����ɶ�����̼������B��C�μ�ϡ����ֱ�����ò�ð����ʱ����ǡ�÷�Ӧ����ȷ��
C���Ӣ�2NaOH+H2SO4�TNa2SO4+2H2O����2NaOH+CO2=Na2CO3+H2O��Na2CO3+H2SO4=Na2SO4+H2O+CO2����ÿ�����������������ᷴӦ����һ�����ᣬÿ������������ת����̼����ʱ������һ��̼���ƣ���ÿ��̼���������ᷴӦʱ����һ�����ᣬ���Ա��������������������䣬��������ϡ�����������������ȣ������ɵ���������������ȣ�����
D���Ԣ�CO2+2NaOH=Na2CO3+H2O����Na2CO3+H2SO4=Na2SO4+H2O+CO2����������ʽ�ۺϣ�������ӣ����ɵã�2NaOH+H2SO4=Na2SO4+2H2O�����������Ʊ������Ӱ�������Ƶ����ɣ������ɵ�������������ȣ������������Ƶ�����Ϊx
2NaOH+H2SO4=Na2SO4+2H2O
80 142
$\frac{12}{3}g$ x
$\frac{80}{142}=\frac{\frac{12}{3}g}{x}$
x=7.1g����ȷ��
��ѡC
���� ���⿼�����������Ƶ��йص����ʣ��������Ƶı��ʼ���ؼ��㣬��ɴ��⣬�����������е�֪ʶ����ѧ����ʽ���йؼ�����У�


 ״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д�
״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1��8 | B�� | 2��9 | C�� | 11��16 | D�� | 12��17 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ���� | a | b | c | d |
| ��Ӧǰ����g | 2 | 22 | 34 | 0 |
| ��Ӧ������g | 2 | 40 | ���� | 16 |
| A�� | �÷�Ӧ��cȫ���μӷ�Ӧ | B�� | �÷�Ӧ���ڷֽⷴӦ | ||
| C�� | �÷�Ӧ������b������Ϊ40g | D�� | a�ڷ�Ӧ�п����Ǵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2����ԭ�ӣ�2N | B�� | �����ӣ�Al+3 | C�� | 2������ӣ�2H | D�� | ����ͭ��CuNO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ܵı�����Ϳ���ᣬ��Ҫ��Ϊ������ | |
| B�� | ���ս������Ϲޣ�ֻ��Ϊ�˼��ٻ�����Ⱦ | |
| C�� | ������Ͱ�м�������ͭ��Һ��ʯ���飬����ɱ����������Һ | |
| D�� | ����ֿ���ʴ�Ժã���������ҽ����е�����ߵ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ҵ�Ͽ�����ʯ�Ҵ������᳧�ķ�ˮ | |
| B�� | ������»�����˵���ƽ���۵�� | |
| C�� | �ø�ѹˮǹ����ԭ���ǽ����˿�ȼ����Ż�� | |
| D�� | ũҵ�Ͽ�����Ͱʢ��ũҩ������Һ��������ͭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
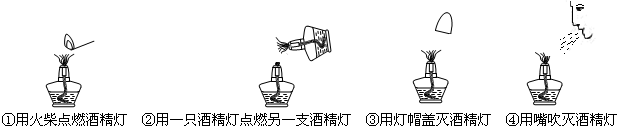
| A�� | �٢� | B�� | �ڢ� | C�� | �ۢ� | D�� | �ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ȼ������������ȼ�� | B�� | ���������Ż𣬿��øɱ����� | ||
| C�� | ��ȼ����ǰһ��Ҫ�鴿 | D�� | �Ͻ�Я����ȼ���ױ���Ʒ�ϳ��� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com