
����Ŀ��(1)�û�ѧ�����ʾ��
��ԭ��___��������������___���Ȼ����е�������___�������к�����������_______
(2)�����������ʵ���ĸ�����գ�
A.����ͭ b.����c.̼���� d.��ʯ��
�ٿ����ڸ����������Ե��� ______�������Ƽ�Ƶļ�_______
���������Ʋ�����Һ����___�� �ܿ����ڽ�������������_____��
(3)�û�ѧ����ʽ��ʾ���·�Ӧ��
��ͭ����������Һ____ �������������_______
����˿�ڴ�����ȼ��_____ �ܵ��ʳ��ˮ�õ��ռ����������_______
���𰸡� Al NO2 Na+ H2O d C a b 2AgNO3+Cu==Cu(NO3)2+2Ag 2KClO3![]() MnO22KCl + 3O2�� 3Fe + 2O2
MnO22KCl + 3O2�� 3Fe + 2O2![]() Fe3O4 2NaCl+2H2O
Fe3O4 2NaCl+2H2O![]() 2NaOH+H2��+Cl2��
2NaOH+H2��+Cl2��
�����������⿼���˳�����ѧ�������д����дʱע��淶��
��1����ԭ�ӿ�������Ԫ�ط��ű�ʾ����ʾΪAl�������������ɶ����������ӹ��ɵģ������������ӿ��ö��������Ļ�ѧʽ��ʾ����ʾΪ2NO2���Ȼ����е��������������ӣ�����ΪNa+�������к�������������ˮ����ѧʽΪ��H2O��
(2) ����ʯ�Ҿ��м��Կ����ڸ����������Ե����������Ƽ�Ƶļ���̼���Ƣ��������Ʋ�����Һ��������ͭ��������������������Ӧ�������ڽ�������������������Դ�Ϊ��dcab��
(3) ��ͭ����������Һ��Ӧ��������ͭ��������Ӧ�Ļ�ѧ����ʽΪ��2AgNO3+Cu==Cu(NO3)2+2Ag��
���������������������ؼ����ڶ������̵Ĵ��������Ȼ��غ���������Ӧ�Ļ�ѧ����ʽΪ��2KClO3 �� MnO2 2KCl + 3O2 ����
����˿�ڴ�����ȼ��������������������Ӧ�Ļ�ѧ����ʽΪ��3Fe + 2O2 ��ȼ Fe3O4�� �ܵ��ʳ��ˮ�õ��ռ��������������Ӧ�Ļ�ѧ����ʽΪ��2NaCl+2H2O![]() 2NaOH+H2��+Cl2����
2NaOH+H2��+Cl2����


 ��������ϵ�д�
��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2017�꡶��ѧ���桷һƪ���³ƣ�ֻ������ͨ�����������Ȼ���Ϳ�㣬���ܽ���ת��Ϊ����Ч���֡�������ʹ�ù����У�Ϳ���е��Ȼ��ƻ��ܽ��ڲ�������Я����ˮ�У��γ���Һ��ɱ��������ɱ��������ˮ���������Ȼ����ٴ�������
��1����ԭ��ת��Ϊ�����ӣ�����������__________������С�����������£��Ȼ��Ƶı�����Һ�У��Ȼ�����ˮ��������Ϊ__________����֪�������£��Ȼ��Ƶ��ܽ��Ϊ36g����
��2�������Ȼ��Ƶ������ӷ���Ϊ__________������ʹ�ù����У��Ȼ�����Һ��������������__________����ı䡱���䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ������ȡ������װ�ã��Իش�
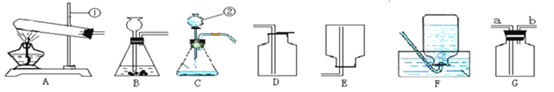
д��ͼ�б�ŵ��������ƣ���______ ��_______
��1��ʵ���������ù���������Һ��ȡһƿ��������Ӧ�ķ���ʽ��_________________________����Ҫ��ø����������������װ���⣬��Ӧѡ��Gװ�ã����ڸ�װ����ʢ�� __________����д�Լ����ƣ��������Gװ���ռ������壬�������_____�˽��루�a����b������
��2����֪������ط�ĩ����ʱ���Ժܿ���������������õķ���װ����_____������Ϊ���ø��������ȡ������ԭ����_______��
��3��ʵ�����ڳ������ÿ�״��ʯ��ˮ��Ӧ��ȡ����ˮ����Ȳ���壬�÷�Ӧ�����ϸ���Ƽ�ˮ�ٶȣ�������ҷ�Ӧ����������װ��ը�ѡ�����Ϊ��ͼ�����ʺ���ȡ��Ȳ����ķ���װ����____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС��ͬѧ��NaOH��Na2CO3��NaHCO3��NaCl�ȳ������ƵĻ�����������о���
��֪ʶ�عˡ��������˵����ȷ����____��
A�����������������ռ�����ڸ����������� B��̼�����׳ƴ�����ڼ�
C��̼�������׳��մ���������θ����� D���Ȼ�������Ȼ������Ҫ�����ں�ˮ��
��������⡿NaOH¶���ڿ������ױ��ʣ���ôʵ�����е�����������û�б����أ���С��ͬѧ��ʵ������һƿ�������ƹ�����Ʒ�ijɷֽ�����̽����
���������ϡ���NaOH�ڿ����в���ת����NaHCO3��
��BaCl2��Һ�����ԣ�Ba(OH)2�ǿ����Լ
��CO2�ڱ��͵�NaHCO3��Һ�м������ܽ⡣
��������롿����٣���Ʒ��ֻ��NaOH
����ڣ���Ʒ��ֻ��Na2CO3
����ۣ���Ʒ�м���NaOH����Na2CO3
NaOH���ʷ�Ӧ�Ļ�ѧ����ʽΪ______________________��
��ʵ��̽������ȤС��ͬѧ�������ʵ�����̽����
ʵ����� | ʵ����������� |
1.ȡ������Ʒ��������ˮ�� | ��Ʒȫ���ܽ⣬����ɫ��Һ�� |
2.ȡ����ʵ��1������ɫ��Һ���Թ��У��μ�����ϡ���ᡣ | �����ݲ����������_____����١������ڡ��ۡ����������� |
3.ȡ����ʵ��1������ɫ��Һ���Թ��У��μ� ________��Һ�� | �а�ɫ�����������йػ�ѧ����ʽΪ________�� |
4.����һ��ʱ���ȡʵ��3���Թ����ϲ���Һ���μ� _______�� | ��Ӧ����____ �������۳����� |
�������о���������Ʒ���ʵij̶�����أ�����ȤС��ͬѧ�����ͼװ�òⶨ��Ʒ��Na2CO3������������

�������£�
�ٰ�ͼ���Ӻ�װ�ã�����������ԣ�
��ȷ��ȡ����Ʒ1.0g��������ƿ�ڣ�
�۴�Һ©���������μ�30.0%��ϡ�������������رջ�����
�ܷ�Ӧ��������Ͳ��Һ��Ķ���Ϊ55.0mL������֪�����������£�CO2���ܶ�Ϊ1.6gL��1��
�� Bװ�ü���ƿ��ԭ�еĿ�����ʵ����____����С���û�С���Ӱ�졣)
�� B�м���ƿʢװ�ı��͵�̼��������Һ������ˮ���棬��������___________________��
�� ��ַ�Ӧ��װ��A�в����Ķ�����̼��ʵ�����Ƿ�������Ӱ�죿____����С���û�С���
�� �������Ʒ��Na2CO3����������______��д��������̣����������0.1%����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��Ȼ������ʵ�̼����13.6g��������������Ϊ7.3%ϡ���ᣬ����ϡ�����������pH�Ĺ�ϵ��ͼ��ʾ��
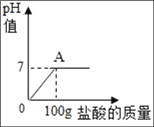
(1)100gϡ�������Ȼ��������__��
(2)��ȫ��Ӧ�������ɶ�����̼������Ϊ____________��(д�����㲽��)
(3)��ȫ��Ӧ��������Һ�����ʵ���������Ϊ____________��(д�����㲽��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʻ���Ʒ��Ϊ�����г�����

(1)��������ζƷ����_______________(����ţ���ͬ)����ʹ�õ���Ҫ�����У������л��ϳɲ��ϵ���______________��
(2)����������ʳ��ĸ��ñ��ʣ���ɺܴ���˷ѡ�
ʳƷ��ˮ��������������,�罫�߲�����,������������ˮ���Ӽ��___(����������������С��).����������һ�ֳ��õ�ʳƷ������,�仯ѧʽΪC6H5CO2Na��������___��Ԫ����ɡ����۳�����ʳƷ���ʣ���ԭ����___.
(3)��Դ��������������������ᷢչ������ء�
ʩ�û��ʿ��������ʳ����,�����û���ɻ�����Ⱦ������������,�������طʵ���___(�����).
A.K2SO4B.CO(NH2)2C.NH4NO3D.Ca(H2PO4)2
��ʯȼ�ϵȲ���������Դ�����ݽߣ����п�������Դ�������ܡ�___�ȡ�
(4)�������ִ������в���ȱ�ٵĴ������ߡ�
������·�еĵ���һ������ͭ���ģ�����������ͭ����չ�Ժ�___�ԣ��������ʹ����Ȼ����ȼ�ϣ��Կ�������Ⱦ���С����Ȼ������Ҫ�ɷ���___���������Ҫ����Ϊ�֣���һ�����ĺϽ𣬹�ҵ����һ����̼�ͳ�����ʯ�����ķ�Ӧ��ѧ����ʽΪ___.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��a��b��c�������ʵ��ܽ�����ߣ�����˵����ȷ����(����)
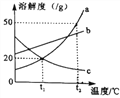
A. ���¶����ߣ�a��b��c�������ʵ��ܽ�Ⱦ�����
B. t2��ʱ����50g a����50gˮ�У��ɵõ�100g a�ı�����Һ
C. ��t2��ʱ��������a��b������Һ���µ�t1�棬�������������a����b
D. t1��ʱ��a��c����Һ�����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ǵ�����������֭����������ζ��ˮ�����һ����Ҫ��Ӫ�����ʣ������������������������Ҫ��Դ֮һ�����й��������ǵ�˵����ȷ����( )
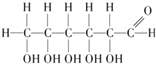
A. �����Ƿ�����̼Ԫ�ص�����������С
B. �����Ƿ�����6��̼ԭ�ӣ�12����ԭ�Ӻ�6����ԭ�ӹ���
C. �����Ƿ�����C��H��O����Ԫ�ص�ԭ�Ӹ�����Ϊ1��2��1
D. �������Ƕ�ԭ�ӷ��ӹ��ɵ��л��߷��ӻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���γǵij��н����ν���������죬�ڳ��н��衢�����������в������Ź㷺��Ӧ�á�
(1)����������Ʒ����Ҫ���ý����������õ����Ե���________(�����)��һ��ͭ����������о���ϩ��Ե�㣬����ϩ����________���ϡ�

(2)����Ʒ�ڿ����лᷢ����ʴ����ԭ������������е�___________��ͬ���õĽ����Ϊ��ֹ������Ʒ����ʴ�������е������Ͳ˵�ͨ�������ķ�����_____________(Ҫ��һ�ַ�������)��
(3)��ѧС��Ϊ����֤����ͭ��þ�����Ľ������˳�����������ʵ�鷽����
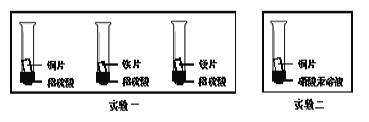
����ʵ��һ�жϳ�þ�Ľ�����Ա���ǿ�����ݵ�������___________������ʵ���������Ӧ�ó��Ľ�����__________��
(4)����ͬѧ����FeSO4��CuSO4�������ʵ���Һ�У�����һ������þ�ۣ���ַ�Ӧ����ˣ���Һ��dz��ɫ��������Һ�з���һö�ྻ���������㹻ʱ���ȡ�������������ޱ仯�����ݴ����������������жϣ�����Ϊ��ȷ����_____________(�����)��
A. ��ֽ��һ����Fe��������Mg��Cu
B. ��ֽ��һ����Cu��������Fe��һ��û��Mg
C. ��Һ��һ����FeSO4��������MgSO4 ��CuSO4
D. ��Һ��һ����MgSO4��FeSO4��һ��û��CuSO4
(5)Ϊ����ij������ͭ��ͭ��ɵĻ����������ͭ��������������ȡ3�ݸû�����20g���ֱ������뵽50g��100g��150gijϡ�����У��������ʵ�����������
��I�� | �ڢ��� | �ڢ��� | |
ϡ���������/g | 50 | 100 | 150 |
�ܽ���������/g | 10.0 | 16.0 | 16.0 |
����ʵ�鼰�й����ݽ��з�������㣺
�ٵ�I��ʵ���з�Ӧ��___________(��������ͭ������ϡ��������������ͭ��ϡ������)��Ӧ�ꡣ
��20g��Ʒ�к�����ͭ�����������ֱ�Ϊ____________��
�ۼ������õ�ϡ�������ʵ���������Ϊ____________(д���������)
�ܽ��ڢ���������ˣ�����Һ�еμ�10%��NaOH��Һ�������ڸû����Һ�м���10%NaOH��Һ�����������ɳ��������仯��ϵ������ͼ��
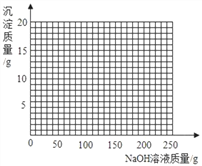 ___________________
___________________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com