解:(1)pH试纸的使用方法是:撕一小段pH试纸置于表面皿中,用玻璃棒蘸取试液滴在pH试纸上,再与标准比色卡对照读出pH值;
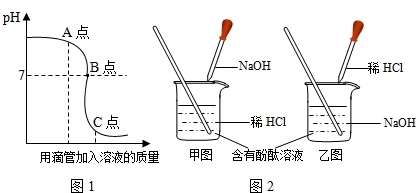
(2)由曲线图1开始溶液的pH是大于7,说明了是向氢氧化钠的溶液中加入稀盐酸.所以,实验操作是按照以上乙图所示进行;
(3)由曲线图1可知,在图中A点时,溶液的pH大于7,说明了向氢氧化钠的溶液中加入稀盐酸的量不足,溶液中有生成的NaCl和未反应的NaOH;
(4)设100gNaOH溶液中溶质的质量为x,生成氯化钠的质量为y
HCl+NaOH═H
2O+NaCl
36.5 40 58.5
100g×7.3% X y

解得:X=8g
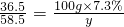
解得:y=11.7g
①该NaOH溶液的溶质质量分数是:
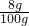
×100%=8%
②得溶液的溶质质量分数是:
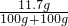
×100%=5.85%
故答为:(1)撕一小段pH试纸置于表面皿中,用玻璃棒蘸取试液滴在pH试纸上,再与标准比色卡对照读出pH值;(2)乙;(3)NaOH、NaCl;(4)①8%;②所得溶液的溶质质量分数是5.85%.
分析:(1)根据pH试纸的使用方法回答;
(2)根据曲线图1开始溶液的pH判断;
(3)根据向氢氧化钠溶液中加入的稀盐酸的量分析溶液中溶质;
(4)当氢氧化钠与稀盐酸恰好完全反应时,溶液pH=7.根据氢氧化钠与稀盐酸的反应,由盐酸溶液中溶质的量可以出氢氧化钠、氯化钠质量,就可以进行有关计算.
点评:本题以图象的形式考查了酸碱中和反应时溶液PH的变化以及物质间的质量关系,完成此题,可以依据已有的知识进行.


 解得:X=8g
解得:X=8g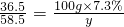 解得:y=11.7g
解得:y=11.7g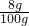 ×100%=8%
×100%=8%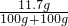 ×100%=5.85%
×100%=5.85%

 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案