
 (2012?宁德)某微粒的结构示意图如图所示.从中获得该微粒的信息正确的是
(2012?宁德)某微粒的结构示意图如图所示.从中获得该微粒的信息正确的是

科目:初中化学 来源: 题型:
| 温度/℃ | 20 | 30 | 50 | 60 | 80 | |
| 溶解度/g | K2CO3 | 110 | 114 | 121 | 126 | 139 |
| KNO3 | 31.6 | 45.8 | 85.5 | 110 | 169 | |
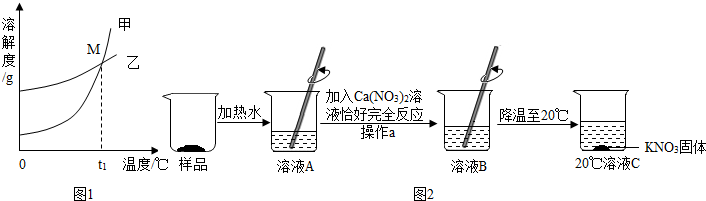
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:初中化学 来源: 题型:
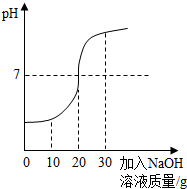 (2012?宁德)化学兴趣小组对某工业废水(含有H2SO4、Na2SO4)中H2SO4的含量进行测定.甲、乙两同学各提出不同的测定方法:
(2012?宁德)化学兴趣小组对某工业废水(含有H2SO4、Na2SO4)中H2SO4的含量进行测定.甲、乙两同学各提出不同的测定方法:查看答案和解析>>
科目:初中化学 来源: 题型:
| 城市 | 污染指数 | 首要污染物 | 级别 | 状况 |
| 福州市 | 34 | -- | I | 优 |
| 厦门市 | 34 | -- | I | 优 |
| 漳州市 | 5 1 | 可吸入颗粒物 | Ⅱ | 良 |
| 泉州市 | 3 9 | -- | I | 优 |
| 48 | -- | I | 优 | |
| 莆田市 | 30 | -- | I | 优 |
| 南平市 | 5 1 | 二氧化硫 | Ⅱ | 良 |
| 龙岩市 | 3 7 | -- | I | 优 |
| 宁德市 | 3 9 | -- | I | 优 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com