
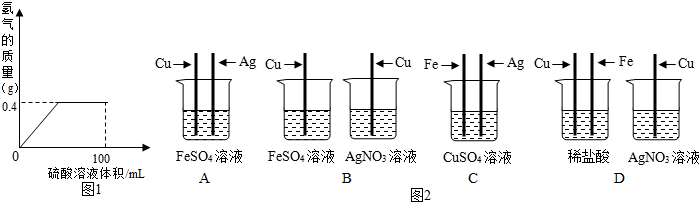
���� ��1������ͼ���е����ݿ��Կ���������ϡ������������0.4�˺�����������������ӣ����岻�����ӽ��з�����
��2������п�����ᷴӦ��������п��������������ɵ��������������п��������
��3��������������Ӻͱ����ӻ��������ᱵ���������������غ���н��
��4�������ڽ������˳���У���ǰ�Ľ��������ᷴӦ����������λ����ǰ�Ľ����ܽ�λ�����Ľ�����������Һ���û��������з�����
��� �⣺��1��ͨ��ͼ���е����ݿ��Կ���������ϡ������������0.4�˺�����������������ӣ����岻�����ӣ�����������ʣ�ࣻ
��2������Ʒ��п������Ϊx���μӷ�Ӧ����������Ϊy����������п������Ϊz
Zn+H2SO4�TZnSO4+H2��
65 98 161 2
x y z 0.4g
$\frac{65}{x}$=$\frac{98}{y}$=$\frac{161}{z}$=$\frac{2}{0.4g}$
x=13g
y=19.6g
z=32.2g
���Ի�ͭ��Zn����������Ϊ��$\frac{13g}{13g+27g}$��100%=32.5%��
��3����ԭ������Һ����������Ϊx
��Zn+H2SO4�TZnSO4 ZnSO4+BaCl2=BaSO4��+ZnCl2 BaCl2+H2SO4=BaSO4��+2HCl�ã�
H2SO4-----BaCl2
98 208
100mL��1.2g/mL��x 400g��26%
$\frac{98}{100mL��1.2g/mL��x}$=$\frac{208}{400g��26%}$
x=40.8%
��4��A��ͭ����������������������Ӧ��������֤����A����
B��ͭ�����û������������е��������û����������е�����������֤���ֽ����Ļ��˳��B��ȷ��
C�������û�������ͭ�е�ͭ���������û�������ͭ�е�ͭ��������֤���ֽ����Ļ��˳��C��ȷ��
D�����������ᷴӦ��ͭ���������ᷴӦ��ͭ������������Ӧ��������֤���ֽ����Ļ��˳��C��ȷ��
��ѡ��BCD��
�ʴ�Ϊ����1���ǣ�
��2����ͭ��Zn����������Ϊ32.5%��
��3��ԭ������Һ����������Ϊ40.8%��
��4��BCD��
���� ������Ҫ�����йػ�ѧ����ʽ�ļ�������������ļ��㣬�ѶȽϴ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ԫ�� | B�� | ��ԭ�� | C�� | ������ | D�� | ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������Һ�����ƿ��������������н��� | |
| B�� | ����Ʒ����ʴ����������Ʒǿ | |
| C�� | ��ZnCl2��Һ��Fe��Cu������������֤Zn��Fe��Cu���ֽ����Ļ��ǿ��˳�� | |
| D�� | �����в��ý���������ͭ���������ߵ�ԭ�������ĵ����Ա�ͭ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Һ������һ�����ʺ�һ���ܼ���ɵ� | |
| B�� | ��Һ������ֵ���������ͬ�� | |
| C�� | ֻҪ�������䣬��ˮ����Dz��������� | |
| D�� | ͨ����ָ���ܼ�����Һ��ˮ��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ��̽����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 4P+5O2 $\stackrel{��ȼ}{��}$ 2P2O5 | B�� | C+O2 $\stackrel{��ȼ}{��}$ CO | ||
| C�� | Zn+CuSO4��ZnSO4+Cu | D�� | CaCO3+2HCl��CaCl2+CO2��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
| �¶�/�� | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| �ܽ��/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com