
【题目】在A+3B=2C+2D的反应中,14克A完全反应生成44克C和18克D,若A的相对分子质量为28,则B的相对分子质量是
科目:初中化学 来源: 题型:
【题目】富含淀粉的谷物、甘薯等可以酿酒.在酿酒过程中淀粉在酶的作用下转化为葡萄糖,葡萄糖发酵为酒精.香甜的酒酿就是利用该原理,用酒曲酶(俗称酒药)制作的.家庭一般制作酒酿的简单流程图如下(注:有机反应化学方程式可用箭号表示):
![]()
(1)配平化学方程式:(C6H10O5)n(淀粉)+________H2O![]() nC6H12O6(葡萄糖).
nC6H12O6(葡萄糖).
(2)如温度、水分等因素控制不当,易导致乳酸量过多而味偏酸,请完成该反应的化学方程式:C6H12O4(葡萄糖)![]() 2________(乳酸).
2________(乳酸).
(3)成熟的酒酿放置时间越长酒味越浓,因为更多的葡萄糖在酒化酶作用下发酵分解为酒精(C2H5OH)和二氧化碳,写出该反应的化学方程式:________________________________________________.
(4)若用1kg大米酿米酒,假设其中有0.81kg的淀粉全部转化为酒精,则理论上可酿制含酒精质量分数为10%的米酒________kg.
[提示]由淀粉转化为酒精的关系式为(C6H10O5)n~2nC2H5OH.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图为某抗酸药的实物图,回答下列问题.

(1)图中标示的物质中,含有的金属元素是________(写出一种即可),属于有机合成材料的是________.
(2)淀粉属于________(填字母序号).
a.蛋白质
b.糖类
c.油脂
d.维生素
(3)图中的塑料包装废弃后可用于微型实验.如鉴别氢氧化镁和碳酸氢钠(均可作抗酸药)两种白色粉末时,可分别取少量样品放入废弃包装的两个孔穴中,再滴入________(填试剂名称),有________(填现象)的,原物质是碳酸氢钠.
(4)另一种抗酸药的主要成分是三硅酸镁,其化学式为Mg2Si3O8·nH2O,能与盐酸发生复分解反应,则反应后产物中含镁的化合物是________(填化学式).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如果将物质按单质、氧化物、酸、碱、盐、有机物分类,下图中甲、乙、丙是三种不同类别的物质,且相连物质间均能发生化学反应,下列说法符合图示要求的是( )
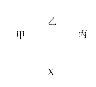
A.当甲为氯化铵时,X可以为氢氧化钾
B.当甲、乙、丙分别为酸、碱、盐时,X一定不可能为碳酸钠
C.当X为氧气时,甲、乙、丙可以为氢气、红磷、葡萄糖
D.当X为稀盐酸时,甲、乙、丙可以为铜、氢氧化铜、硝酸银
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有X、Y、Z三种金属,将X、Y分别放入稀硫酸中,结果Y表面产生气泡,X表面无明显现象;另取X放入Z的盐溶液中,结果X表面有Z析出。则X、Y、Z三种金属的活动性顺序是
A.Y>Z>X B.X>Y>Z C.X>Z>Y D.Y>X>Z
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某厂排放的废水中含有碳酸钠,易造成环境污染.化学兴趣小组为该厂设计废水处理和利用的方案,进行了如下实验:取过滤后的水样200g,逐滴加入稀盐酸至恰好不再产生气体为止,反应过程中生成气体与所加稀盐酸的质量关系如图所示.回答下列问题(不考虑水样中杂质的影响):
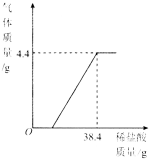
(1)反应生成CO2气体的质量是________g.
(2)反应后生成氯化钠的质量是多少?(写出计算过程)
(3)农业上常用10%~20%的氯化钠溶液来选种.请通过列式计算判断:上述实验恰好完全反应后所得溶液能否直接用于农业上选种?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】明胶常应用于制药和食品工业,其所含的一种蛋白质在人体内水解,可得产物之一是苯丙氨酸(C9H11O2N)。下列关于苯丙氨酸的说法正确的是
A.属于氧化物
B.由C、H、O、N四种元素组成
C.由23个原子构成
D.各元素的质量比为9∶11∶2∶1
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(10分)“氯碱工业”是我国目前化学工业的重要支柱之一,它的主要原理是电解饱和食盐水,其化学方程式为: x NaCl+ 2 H2O![]() x NaOH+ H2↑+ Cl2↑。在20℃时,取100g饱和NaCl溶液进行电解,一段时间后测得产生氯气(Cl2)的质量为7.1g。(已知:20℃时,NaC1的溶解度为36g)请分析并计算回答:
x NaOH+ H2↑+ Cl2↑。在20℃时,取100g饱和NaCl溶液进行电解,一段时间后测得产生氯气(Cl2)的质量为7.1g。(已知:20℃时,NaC1的溶解度为36g)请分析并计算回答:
(1)运用质量守恒定律可知上述反应中x= 。
(2)通过计算,上述过程中同时产生H2的质量为 g。
(3)计算电解后剩余溶液中NaC1的质量分数(写出详细的计算过程,结果精确到0.1%)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com