解:(1)t
2℃时,A的溶解度为50g或50g/100g水;
(2)在t
1℃到t
2℃之间,B、C的溶解度曲线没有交点,故不能配制成溶质质量分数相同的饱和溶液;
(3)A物质的溶解度随温度升高而变化较大,而B物质的溶解度受温度影响较小,所以要从混有少量B的A中提纯A,用降温结晶法提纯A;
(4)A的溶解度随温度的升高而增大,所以要将一接近饱和的A溶液变为饱和溶液,可采取加入溶质、蒸发溶剂、降温的方法;
(5)t
1℃时,AC的溶解度相等,则等质量的饱和溶液中所含溶质的质量相等,现在不知溶液的状态,则无法判断溶质的质量关系;
(6)由饱和溶液中溶质的质量分数计算式可知,溶解度越大,则饱和溶液中溶质的质量分数越大;因为t
2℃时A、B、c三种物质的溶解度大小是:A>B>C,所以t
2℃时A、B、C的饱和溶液的质量分数是A>B>C,降温后A和B都析出晶体,仍然是饱和溶液,又因为t
1℃时,B的溶解度大于A的,所以t
1℃时,B的饱和溶液的质量分数大于A物质的饱和溶液的质量分数;由于C物质降温后变为不饱和溶质质量分数不变,所以要比较C物质在t
2℃时的溶解度与t
1℃时A、B的溶解度大小,即溶液中溶质的质量分数大小,通过图表可知:B>A>C;
故答案为:(1)50g或50g/100g水;
(2)不能;
(3)降温结晶(或冷却热饱和溶液);
(4)加入A(或蒸发溶剂、降低温度);
(5)否;
(6)B>A>C.
分析:(1)根据溶解度曲线可知物质在某温度下的溶解度;
(2)同一温度下物质的溶解度相等则溶质的质量分数相等;
(3)A物质的溶解度随温度升高而变化较大,而B物质的溶解度受温度影响较小,据此分析解答;
(4)据A的溶解度随温度变化情况及不饱和溶液、饱和溶液的相互转化分析解答;
(5)t
1℃时,AC的溶解度相等,则等质量的饱和溶液中所含溶质的质量相等,若不知溶液的状态,则无法判断溶质的质量关系;
(6)据三种溶质的由溶解度曲线及饱和溶液中溶质的质量分数的计算式

×100%分析解答.
点评:本题容易出错的地方是将t
2℃时三种物质的饱和溶液降温至t
1℃时,溶液中溶质的质量分数的大小比较,明确饱和溶液中溶质的质量分数计算方法,并能结合物质的溶解度随温度的变化情况才能正确解答,在分析解答时要结合所学知识细心分析解决问题.

 根据如图A、B、C三种固体的溶解度曲线回答:
根据如图A、B、C三种固体的溶解度曲线回答: ×100%分析解答.
×100%分析解答.

 金钥匙试卷系列答案
金钥匙试卷系列答案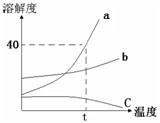 23、根据如图a、b、c三种物质的溶解度曲线,回答下列问题.
23、根据如图a、b、c三种物质的溶解度曲线,回答下列问题. (2012?虹口区二模)根据如图A、B、C三种固体的溶解度曲线回答:
(2012?虹口区二模)根据如图A、B、C三种固体的溶解度曲线回答: 根据如图A、B、C三种固体的溶解度曲线回答:
根据如图A、B、C三种固体的溶解度曲线回答: