
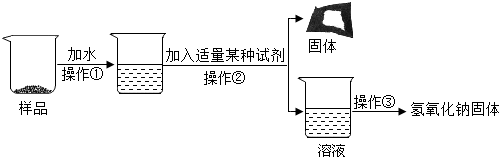
分析 长期暴露在空气中的氢氧化钠固体能与空气中的二氧化碳反应生成了碳酸钠,常见加入适量氢氧化钙将碳酸钠除去,通过过滤得到氢氧化钠溶液,最后通过蒸发得到固体的氢氧化钠.据此分析回答有关的问题.
解答 解:(1)由于长期暴露在空气中的氢氧化钠固体,能与空气中的二氧化碳反应生成了碳酸钠,常见加入适量氢氧化钙将碳酸钠除去,在通过过滤得到氢氧化钠溶液,最后再通过蒸发得到固体的氢氧化钠,所以,操作①、②、③分别是溶解、过滤、蒸发.
(2)由上述分析可知,反应过程中有生成的氢氧化钠,所以最终所得氢氧化钠固体质量大于变质后样品中氢氧化钠的质量.
故答为:(1)溶解,过滤,蒸发;(2)大于;
点评 本题的难度不大,了解氢氧化钠变质的原因和除去的杂质的方法是解答本题的关键.


 走进文言文系列答案
走进文言文系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 乳酸是一种氧化物 | |
| B. | 一个乳酸分子是由一个碳原子和3个水分子构成 | |
| C. | 葡萄糖和乳酸中氢元素的质量分数相等 | |
| D. | 葡萄糖中碳元素和氧元素的质量比是1:1 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
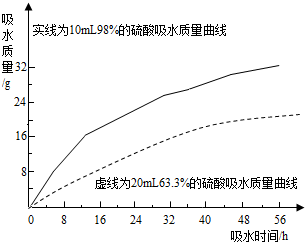 硫酸是常见的酸,也是常用的化工原料.由于浓度不同,浓硫酸与稀硫酸在性质上存在较大差异,如浓硫酸具有脱水性、吸水性和强腐蚀性等.某课外兴趣小组为了探究浓硫酸的某些特性做了如下一些实验.请结合有关实验,按要求回答下列问题:
硫酸是常见的酸,也是常用的化工原料.由于浓度不同,浓硫酸与稀硫酸在性质上存在较大差异,如浓硫酸具有脱水性、吸水性和强腐蚀性等.某课外兴趣小组为了探究浓硫酸的某些特性做了如下一些实验.请结合有关实验,按要求回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 钢铁是我们日常生活中使用最广泛的金属材料之一.
钢铁是我们日常生活中使用最广泛的金属材料之一.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com