
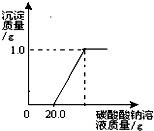
 某班同学在做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其它杂质).为了对废液进行处理,某同学做了如下实验:取废液缸上层清液20.0g于烧杯中,逐滴滴入溶质质量分数为5.3%的碳酸钠溶液直至过量,滴入碳酸钠溶液的质量与生成沉淀的质量的变化关系如图所示.
某班同学在做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其它杂质).为了对废液进行处理,某同学做了如下实验:取废液缸上层清液20.0g于烧杯中,逐滴滴入溶质质量分数为5.3%的碳酸钠溶液直至过量,滴入碳酸钠溶液的质量与生成沉淀的质量的变化关系如图所示.

 ×100%≈4.0%
×100%≈4.0%

科目:初中化学 来源: 题型:
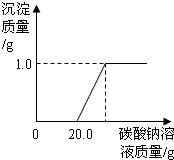 某班同学在做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其它杂质).为了对废液进行处理,某同学做了如下实验:取废液缸上层清液20.0g于烧杯中,逐滴滴入溶质质量分数为5.3%的碳酸钠溶液至过量,滴入碳酸钠溶液质量(/g)与生成沉淀的质量(/g)的变化关系如图所示.(计算结果精确到0.1%)
某班同学在做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其它杂质).为了对废液进行处理,某同学做了如下实验:取废液缸上层清液20.0g于烧杯中,逐滴滴入溶质质量分数为5.3%的碳酸钠溶液至过量,滴入碳酸钠溶液质量(/g)与生成沉淀的质量(/g)的变化关系如图所示.(计算结果精确到0.1%)查看答案和解析>>
科目:初中化学 来源: 题型:
| 测定次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
| 加入Na2CO3溶液/g | 10.0 | 20.0 | 30.0 | 40.0 | 50.0 |
| 杯中物质的总质量/g | 29.78 | 39.56 | 49.56 | 59.56 | 未测 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2006?玄武区一模)某班同学在做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).为了对废液进行处理,某同学做了如下实验:取废液缸中上层清液40mL于烧杯中,逐滴滴入Na2CO3溶液至过量.记录滴入Na2CO3溶液质量(x)与有关量的变化关系如图所示.图中纵坐标(y)表示
(2006?玄武区一模)某班同学在做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).为了对废液进行处理,某同学做了如下实验:取废液缸中上层清液40mL于烧杯中,逐滴滴入Na2CO3溶液至过量.记录滴入Na2CO3溶液质量(x)与有关量的变化关系如图所示.图中纵坐标(y)表示查看答案和解析>>
科目:初中化学 来源: 题型:
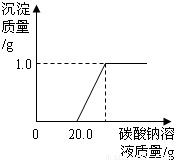
 某班同学在做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其它杂质).为了对废液进行处理,某同学做了如下实验:取废液缸上层清液20.0g于烧杯中,逐滴滴入溶质质量分数为5.3%的碳酸钠溶液直至过量,滴入碳酸钠溶液的质量与生成沉淀的质量的变化关系如图所示.
某班同学在做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其它杂质).为了对废液进行处理,某同学做了如下实验:取废液缸上层清液20.0g于烧杯中,逐滴滴入溶质质量分数为5.3%的碳酸钠溶液直至过量,滴入碳酸钠溶液的质量与生成沉淀的质量的变化关系如图所示.查看答案和解析>>
科目:初中化学 来源:2009年江苏省如东实验中学中考化学模拟试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com