有A、B两种混合粉末,质量分别为m1,m2.A由CaCO3和KHCO3组成,B由MgCO3和NaHCO3组成.将A、B分别与足量稀盐酸反应,生成二氧化碳气体的质量均为wg.下列说法正确的是______(已知:KHCO3+HCl═KCl+CO2↑+H2O;NaHCO3+HCl═NaCl+CO2↑+H2O)
A.m1=m2
B.21m1=25m2
C.混合物A中CaCO3和KHCO3质量比一定为1:1
D.混合物B中MgCO3和NaHCO3质量比可为任意比.
【答案】
分析:由CaCO
3和KHCO
3分别与稀盐酸反应的方程式可得到,CaCO
3和KHCO
3与二氧化碳的质量比相同,即混合物A中CaCO
3和KHCO
3无论以任何比混和,只要总质量不变生成二氧化碳的量就不变;同样MgCO
3和NaHCO
3与稀盐酸反应的方程式中,MgCO
3和NaHCO
3与二氧化碳的质量比也相同,即混合物B中MgCO
3和NaHCO
3可以以任意比混合.这样就可以根据方程式利用二氧化碳的质量求出m
1和m
2.
解答:解:A、根据CaCO
3+2HCl═CaCl
2+CO
2↑+H
2O、KHCO
3+HCl═KCl+CO
2↑+H
2O这两个方程式可看到:
CaCO
3和KHCO
3与二氧化碳的质量比都是100:44
又因为二氧化碳的质量是wg,所以可列比例式:
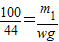
解得:m
1=
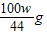
同样根据MgCO
3+2HCl═MgCl
2+CO
2↑+H
2O、NaHCO
3+HCl═NaCl+CO
2↑+H
2O可看出:
MgCO
3和NaHCO
3与二氧化碳的质量比都是84:44
二氧化碳的质量是4.4g可列比例式:
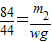
解得:m
2=
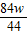
g
所以 m
1≠m
2,故A错;
B、根据A中的解答可以知道:m
1:m
2=
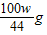
:
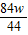
g,化简得21m
1=25m
2,故B正确;
C、混合物A中CaCO
3和KHCO
3质量比可为任意比,混合物B中MgCO
3和NaHCO
3的质量比也可为任意比.故C错误;
D、根据C中的分析可以知道选项D正确.
故选BD.
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

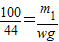
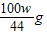
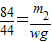
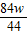 g
g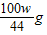 :
: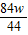 g,化简得21m1=25m2,故B正确;
g,化简得21m1=25m2,故B正确;

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案