
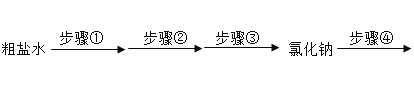
【题目】海水晒盐得到的粗盐中含有少量的CaCl2,Na2SO4、MgCl2杂质。将粗盐经过如下流程净化制得纯净氯化钠,再通过电解饱和食盐水得到相应的产物。请回答:
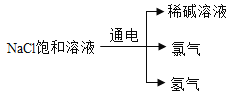
(1)根据所学知识推测,稀碱溶液中的溶质化学式为_____。
(2)在步骤①中除了可以按照BaCl2、NaOH、Na2CO3的顺序添加除杂试剂,其中利用氢氧化钠除去杂质的化学反应方程式为_____。上述试剂的添加顺序还可以选择的是_____(填字母)。
A Na2CO3→NaOH→BaCl2
B NaOH→BaCl2→Na2CO3
C Na2CO3→BaCl2→NaOH
(3)在步骤②中,滴加稀盐酸之前需要进行的操作是_____,滴加稀盐酸的作用是_____。
(4)将20℃时136g氯化钠的饱和溶液(20℃时,氯化钠溶解度为36g)稀释成溶质质量分数为15%的溶液,需要加入水的质量_____g,共主要操作顺序_____(填字母)。
A 计算→量取→混匀→装瓶贴签
B 计算→称量一量取→溶解→装瓶贴签
【答案】NaOH ![]() B 过滤 去除剩余的氢氧化钠和碳酸钠 104g A
B 过滤 去除剩余的氢氧化钠和碳酸钠 104g A
【解析】
(1)氯化钠饱和溶液电解后有氯气和氢气出现,说明电解过程中还要水的参与,而生成了稀碱溶液,因此可以推出为氢氧化钠的溶液,所以溶质为NaOH;
故答案为:NaOH。
(2)去除杂质离子,一般是生成沉淀物,氢氧化钠中氢氧根可与镁离子结合生成氢氧化镁沉淀,所以氢氧化钠与氯化镁反应生成氢氧化镁沉淀和氯化钠,因此该反应的化学方程式为![]() ;改变溶剂的添加顺序,保证杂质离子的顺利去除,同时避免引入新的杂质:
;改变溶剂的添加顺序,保证杂质离子的顺利去除,同时避免引入新的杂质:
A、先加入碳酸钠,可以去除氯化钙,剩余过量的碳酸钠,接着加入氢氧化钠,去除氯化镁,剩余过量的氢氧化钠,最后加入氯化钡,可以去除过量的碳酸钠和硫酸钠,但是还剩余了氯化钡、氢氧化钠,在步骤②加入盐酸,可以去除氢氧化钠,但是盐酸无法去除氯化钡,选项A不符合题意;
B、加入氢氧化钠,去除氯化镁,剩余了过量的氢氧化钠,接着加入氯化钡,去除硫酸钠,剩余了过量的氯化钡,最后加入碳酸钠,可以去除氯化钙,同时去除氯化钡,然后在步骤②中加入盐酸,去除氢氧化钠和碳酸钠,生成了氯化钠,选项B符合题意;
C、加入碳酸钠,去除氯化钙和氯化镁,剩余过量的碳酸钠,接着加入氯化钡,去除碳酸钠和硫酸钠,剩余过量的氯化钡,最后加入氢氧化钠,可以进一步去除氯化镁,同时剩余氢氧化钠,所以此时有剩余的氯化钡和氢氧化钠,在步骤②加入盐酸,可以去除氢氧化钠,氯化钡无法去除,选项C不符合题意;故选B;
(3)步骤①将杂质离子转化为了沉淀,所以加入盐酸前需要固液分离,因此需要过滤;因为加入氢氧化钠和碳酸钠为过量,所以加入稀盐酸后去除剩余的氢氧化钠和碳酸钠;
故答案为:过滤;去除剩余的氢氧化钠和碳酸钠。
(4)此温度下氯化钠溶解度为36g,所以136g饱和氯化钠溶液中则是有36g氯化钠和100g水,其中溶质质量为36g,溶液稀释前后溶质质量不变,设稀释后溶液质量为m,m×15%=36g,求得m=240g,加入水的质量=m-136g=240g-136g=104g;稀释溶液变为15%,通过计算加入所需水的质量,然后换算为水的体积,量取水的体积后,直接加入136g饱和氯化钠溶液,混合均匀,贴上标签,则为所需质量分数的溶液,因此顺序为计算→量取→混匀→装瓶贴签,故选A;
故答案为:A。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
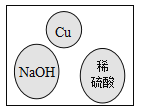
【题目】“化学棋”游戏规则:①每粒棋子代表一种物质;②吃子:所选棋子能与棋盘(如图)中的某棋子发生反应,则棋盘中的该棋子被吃掉;③连吃:前一次反应的生成物能与另一棋子发生反应时,则该棋子也被吃掉。若一次就可连续吃掉棋盘上的所有棋子,应选择的棋子是
A. ![]() B.
B. ![]() C.
C.  D.
D. 
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室部分装置如图所示,请回答下列问题。
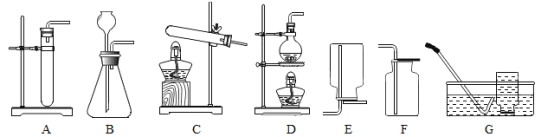
(1)①实验室用大理石和稀盐酸制备CO2的化学方程式为__________。
②用大理石和稀盐酸制备CO2时,能作为发生装置的是A或B,与A装置相比较,B装置的优点是便于在反应过程中________________________。
③选用F装置收集CO2时,验满方法是:____________________。则气体已满.
(2)若在实验室用C作为制备氧气的发生装置,可采用的药品是________________。并写出该反应的化学方程式_________________________________。
(3)选用G装置收集气体时,下列实验操作正确的是______________(填序号).
①反应前,将集气瓶注满水,用玻璃片盖着瓶口,倒立在盛水的水槽中
②收集气体时,等到气泡连续且均匀放出,再将导管口移入集气瓶
③收满气体后,先将集气瓶移出水槽再盖上玻璃片
(4)实验室常用D装置来制备氯气(Cl2),推测其反应物可能是___________。(填序号).
①水和木炭 ②氯化钠固体和二氧化锰 ③浓盐酸和二氧化锰
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室配制50克质量分数为12%的氯化钠溶液。下图是小军实验操作过程示意图:
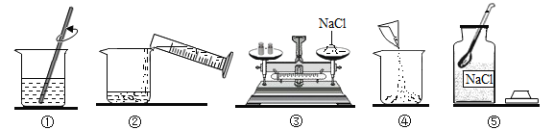
(1)请指出图中一处明显错误的操作_________;改正操作后,用上述图示的序号表示配制溶液的正确操作顺序________;
(2)图①中玻璃棒搅拌的目的是_______;
(3)配制该溶液需要用_________的量筒(填“50mL”、“100mL”或“200mL”)量取水。用己调节平衡的天平称取氯化钠固体时,发现指针偏右,接下来的操作是_______;
(4)经检验,该同学配制的溶液溶质质量分数偏小,可能的原因是_____ ( 填序号)
A 氯化钠固体不纯
B 用生锈的砝码称量
C 装瓶时有少量液体洒出
D 用量筒量取水时,俯视读数
E 溶解的烧杯提前用蒸馏水润洗
(5)将20克12%的氯化钠溶液配制成6%的氯化钠溶液,需加水______克。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室用10g8%的氢氧化钠溶液和稀硫酸进行中和反应实验,实验过程中溶液的pH变化如图所示:
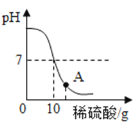
(1)A点溶液的溶质_________。(填化学式)
(2)计算所用的该稀硫酸的质量分数为__________?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙三种物质的溶解度曲线如图所示。下列说法错误的是( )
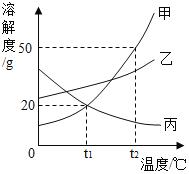
A.t1℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是:乙>甲=丙
B.t2℃时,30g甲物质加入50g水中,充分搅拌后,所得溶液的溶质的质量分数为37.5%
C.将相同质量的甲、乙、丙三种物质的饱和溶液从t1℃升温到t2℃,溶质质量分数由大小关系是乙>甲>丙
D.欲将丙物质的不饱和溶液变为饱和溶液,可以采取升高温度的方法
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是甲、乙两种物质(不含结晶水)的溶解度曲线。下列说法中正确的是(________)

A 甲的溶解度大于乙的溶解度
B t1℃时,50g甲的饱和溶液中有15g甲
C t2℃时甲和乙溶液溶质的质量分数一定相等
D 当甲中含有少量乙时,可以用降温结晶的方法提纯甲
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某合金的主要成分为 Zn、Fe 和 Cu。研究小组利用该合金制成的机械零件废弃物制取高纯度的 ZnO,其部分工艺流程如下图所示。请回答:
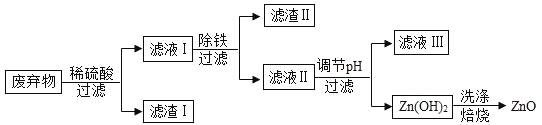
(1)实验前将废弃物处理成粉末的目的是:_________;
(2)滤渣Ⅰ中一定有_________;
(3)加酸溶解废弃物时,需要通风并远离火源,其原因是_________;
(4)焙烧 Zn(OH)2 发生分解反应的化学方程式为_________;
(5)研究小组利用上述的废弃物测定稀盐酸的溶质质量分数,他分四次向 182.5g 稀盐酸中加入含有杂质的废弃物,记录所加废弃物与产生氢气的质量如下表所示。
次数 | 1 | 2 | 3 | 4 |
废弃物质量/g | 5 | 5 | 5 | 5 |
氢气质量/g | 0.15 | 0.15 | 0.1 | 0 |
请帮小组计算稀盐酸的溶质质量分数________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室制取气体所需装置如下图所示。请回答以下问题:

(1)装置中标“a”的仪器名称是_______________;
(2)若用装置 A 制取氧气,则该反应的化学方程式为_____________;
(3)实验室制取二氧化碳时,所选用的发生装置和收集装置的组合是______________(填字母)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com