

分析 (1)根据A-B过程中溶液的pH值逐渐上升,所以发生的反应盐酸和碳酸钠反应生成氯化钠、水和二氧化碳进行分析;
(2)根据B-C过程的反应是碳酸钠和氯化钙反应生成氯化钠和碳酸钙,溶液pH值不会改变,始终等于7进行分析;
(3)根据碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,依据碳酸钠的质量进行计算;
(4)根据碳酸钠和盐酸反应生成了氯化钠,碳酸钠和氯化钙反应也生成了氯化钠,依据元素守恒计算溶质的质量,依据质量守恒计算溶液的中了,然后计算溶质的质量分数;
(5)根据图象中的数据计算与氯化钙反应的碳酸钠的质量和生成沉淀的质量,然后进行作图.
解答 解:(1)A-B过程中溶液的pH值逐渐上升,所以发生的反应盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(2)B-C过程的反应是碳酸钠和氯化钙反应生成氯化钠和碳酸钙,溶液pH值不会改变,始终等于7;
(3)设参加反应的氯化钙的质量为x,生成碳酸钙沉淀质量为y,生成氯化钠质量为z
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 111 100 117
50g×10.6% x y z
$\frac{106}{50g×10.6%}$=$\frac{111}{x}$=$\frac{100}{y}$=$\frac{117}{z}$
x=5.55g
y=5g
z=5.85g
(4)设碳酸钠和盐酸反应生成二氧化碳质量为m,生成氯化钠质量为n
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
50g×10.6% n m
$\frac{106}{50g×10.6%}$=$\frac{117}{n}$=$\frac{44}{m}$
m=2.2g
n=5.85g
所以C点时溶液中溶质的质量分数为$\frac{5.85g+5.85g}{57.2g+100g-2.2g-5g}$×100%=7.8%;
(5)通过分析可知,碳酸钠先于盐酸反应,然后再与氯化钙反应,当加入碳酸钠的质量大于50g时,开始生成碳酸钙沉淀,加入碳酸钠的质量为100g时,沉淀的质量达到了最大值5g,所以图象为
故答案为:(1)Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(2)7;
(3)$\frac{106}{50g×10.6%}$=$\frac{111}{x}$;
(4)7.8%;
(5) .
.
点评 本题主要考查了化学方程式的计算,难度不大,注意解题的规范性和准确性.


科目:初中化学 来源: 题型:填空题
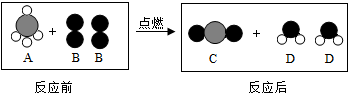
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
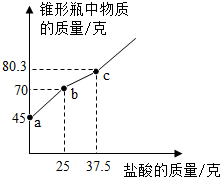 为测定某氢氧化钙(只含有碳酸钙杂质)样品的变质程度,称取研细的该样品12.4g放入锥形瓶中,加入32.6g水,充分振荡形成悬浊液,再向锥形瓶中逐滴滴加盐酸使其充分反应至无气泡产生,测得加入盐酸的质量与锥形瓶中物质的质量关系如图所示.
为测定某氢氧化钙(只含有碳酸钙杂质)样品的变质程度,称取研细的该样品12.4g放入锥形瓶中,加入32.6g水,充分振荡形成悬浊液,再向锥形瓶中逐滴滴加盐酸使其充分反应至无气泡产生,测得加入盐酸的质量与锥形瓶中物质的质量关系如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
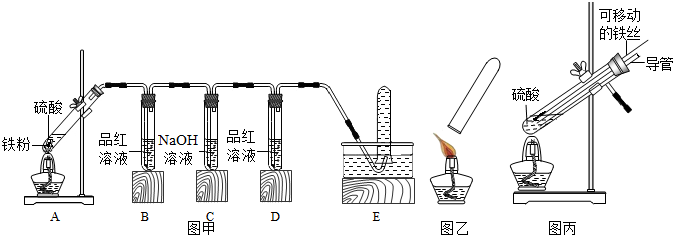
| 实验现象 | |||||
| 硫酸溶液浓度 | B中品红溶液 | D中品红溶液 | 爆鸣实验 | A中生成气体成分 | |
| 实验一 | 98% | 褪色 | 不褪色 | 无爆鸣声 | 只有SO2 |
| 实验二 | 45% | 稍有褪色 | 不褪色 | 有爆鸣声 | 有SO2和H2 |
| 实验三 | 25% | 不褪色 | 不褪色 | 有爆鸣声 | 只有H2 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用托盘天平称取10.12g蔗糖 | B. | 用加热来降低水的硬度 | ||
| C. | 用pH试纸测定溶液pH值为5.6 | D. | 用碱石灰干燥二氧化碳 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com