
【题目】回答下列有关金属的问题:
(1)将黄铜(铜锌合金)片和铜片互相刻画,在_________表面会留下痕迹;
(2)在工业炼铁的反应中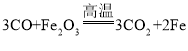 ,发生还原反应的物质是_________;
,发生还原反应的物质是_________;
(3)向 AgNO3、Cu(NO3)2、Mg(NO3)2 混合溶液中,加入一定量的锌粉,充分反应后过滤,得到无色滤液,则滤渣中一定含有的金属是_________。
【答案】铜片 Fe2O3 银和铜
【解析】
(1)合金的硬度比纯金属的大,所以会在铜片表面留下划痕;
故答案为:铜片。
(2)发生还原反应的物质,化合价降低,根据反应方程式可以看出,反应前氧化铁中铁元素为+3价,生成物中铁元素为0价,化合价降低,所以氧化铁发生了还原反应;
故答案为:Fe2O3。
(3)金属活动性为镁>锌>铜>银,所以加入锌粉后,锌会先与硝酸银反应,若锌有剩余再与硝酸铜反应,但是不能与硝酸镁反应,反应后为无色溶液,说明没有硝酸铜的存在,因此硝酸银和硝酸铜全部反应完毕,锌与硝酸银生成银和硝酸锌,锌与硝酸铜反应生成铜和硝酸锌,而锌是否剩余无法判断,所以滤渣中金属一定有银和铜;
故答案为:银和铜。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:初中化学 来源: 题型:
【题目】据统计,我国仅20世纪90年代就发生火灾约89万起,给人民造成重大损失.应用化学知识能有效预防和控制火灾.下面对灭火实例的灭火原理解释不正确的是( )
灭火实例 | 灭火原理 | |
A | 住宅失火时,消防队员用水灭火 | 降低可燃物的着火点 |
B | 酒精在桌上着火时,用湿抹布盖灭 | 隔绝空气或氧气 |
C | 炒菜油锅着火时,用锅盖盖熄 | 隔绝空气或氧气 |
D | 扑灭森林火灾时,设置隔离带 | 可燃物与火源隔离 |
A. B.
B. C.
C. D.
D. 
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是物质间发生化学反应的颜色变化,请回答下列问题:
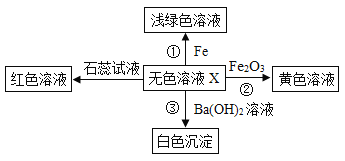
(1)X是实验室里常见的酸,则X的化学式为_____________。
(2)反应③的基本反应类型是______________。
(3)写出有关反应的化学方程式:①________________,②____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有A、B、C、D、E、F、G七种物质,C、F是最常见的金属,B是气体单质,D为浅绿色溶液,G为蓝色溶液,它们之间存在如下关系:

(1)推测下列物质的化学式:B___________,D____________,F___________;
(2)写出A→C转化的化学方程式:_________________________________________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某金属冶炼厂的工业废渣中含有泥沙和某些单质,其中单质含有铜、锌和少部分 硫。现欲回收铜和锌,并对硫进行处理,主要流程如图所示:
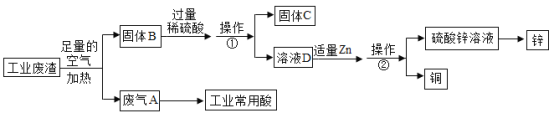
(1)在废气 A 中,一定含有的有害气体是__________(填化学式)。操作①的操作名称是___________。
(2)溶液 D 中含有的溶质是___________(填化学式)。写出由固体 B 生成溶液D 的其中一个反应的化学方程式:_______________。
(3)有人认为若第一步中空气不足量,会导致锌的回收率降低,你认为是否正确?_____(填“正确”或“不正确”),理由是__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】元素周期表中,镁元素的信息如图所示,对图中信息解释不正确的是( )
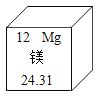
A.核外电子数为 24B.原子序数为12
C.元素符号为MgD.相对原子质量为24.31
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图为初中化学常见实验。

(1)实验A中,由__的体积确定可燃物燃烧消耗氧气的体积。
(2)实验B中,a和b内的气体依次为__,该实验证明水是由__组成的。
(3)某小组进行实验C时,未在锥形瓶上塞橡胶塞,也验证了质量守恒定律,原因是__。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是A.B.C三种固体物质的溶解度曲线,请根据图示回答问题:

(1)t3°C时,将60 g A物质加入50 g水中,充分搅拌后,所得溶液的质量是________________。
(2)图中P点所表示的B物质的溶液为______________(选填“饱和”或“不饱和”)溶液,欲将t1°C时C物质的不饱和溶液变为该温度下的饱和溶液,可采用的一种方法是________________。
(3)将t3°C时A、B、C三种物质的饱和溶液分别降温到t2°C(忽略水的蒸发),三种溶液的溶质质量分数由大到小的顺序是________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数。
(1)配制溶液:
①配制200g8%的氢氧化钠溶液,需水的体积为_____mL(水的密度近似看作1g/cm3)。
②称量时先调节托盘天平平衡,将一只烧杯放在托盘天平的左盘,称量其质量。然后_____(按操作的先后顺序选填字母),直至天平平衡。
A 将氢氧化钠固体加入烧杯中
B 按需要添加砝码、移动游码
③加水充分溶解,并冷却至室温(约20℃)。
(2)用上述配制的氢氧化钠溶液与20g某稀盐酸发生反应的过程中,使用数字传感仪测得溶液温度变化的曲线,如图所示:
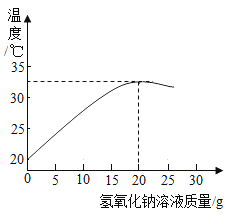
①当加入15g氢氧化钠溶液时,所得溶液中的溶质为_____(用化学式表示)。
②加入_____g氢氧化钠溶液,恰好完全中和。
③试计算此盐酸的溶质质量分数_____。(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com