
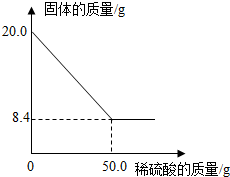
 菱铁矿(主要成分是FeCO3)是炼铁的原料.现取20.0g菱铁矿,向其中加入足量稀硫酸,充分反应(菱铁矿中杂质不参加反应,且难溶于水),测得固体质量与所加稀硫酸的质量关系如图所示.请计算:
菱铁矿(主要成分是FeCO3)是炼铁的原料.现取20.0g菱铁矿,向其中加入足量稀硫酸,充分反应(菱铁矿中杂质不参加反应,且难溶于水),测得固体质量与所加稀硫酸的质量关系如图所示.请计算:分析 (1)根据剩余固体的质量即为杂质的质量,依据杂质的质量可以计算FeCO3的质量;
(2)根据生成物硫酸亚铁的质量和溶液质量计算溶质质量分数.
解答 解:(1)20.0g菱铁矿中FeCO3的质量为:20.0g-8.4g=11.6g;
(2)设生成FeSO4质量为x,CO2质量为y
FeCO3+H2SO4=FeSO4+CO2↑+H2O,
116 142 44
11.6g x y
$\frac{116}{11.6g}=\frac{142}{x}=\frac{44}{y}$
x=14.2g
y=4.4g
所得溶液的质量为:11.6g+50g-4.4g=57.2g
所得溶液的溶质质量分数为:$\frac{14.2g}{57.2g}$×100%≈24.8%.
故答案为:(1)11.6g;
(2)所得溶液的溶质质量分数为24.8%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 水是宝贵的自然资源.
水是宝贵的自然资源.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
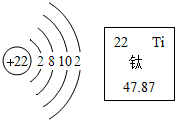
| A. | 该原子的最外层电子能量比最内层电子能量大 | |
| B. | 该原子在化学变化中容易失去电子 | |
| C. | 该元素属于金属元素 | |
| D. | 该原子的质量由其原子的质子和电子决定 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
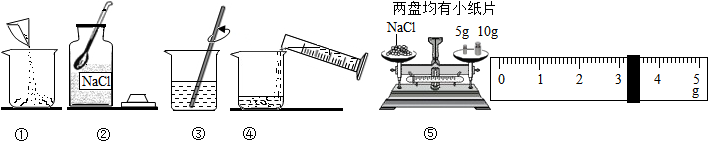
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com