
【题目】宏观辨识与微观探析是化学学习的独特思维。对于溶液中进行的反应及其规律,通过反思与探索,同学们有了新的认识。请回答下列问题:
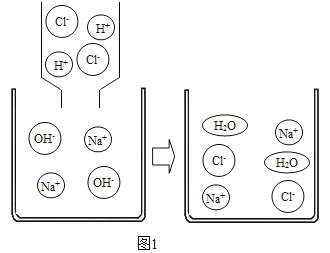
(1)向滴有酚酞的氢氧化钠溶液滴加稀盐酸,完全反应时的现象是_____;反应的微观示意图如图1,反应能进行的原因是溶液中H+和OH-的数目减少,即自由移动的离子数目减少,反应的实质:_____。
(2)碳酸钠溶液中滴加盐酸反应现象为_____,反应实质:2H++CO32-=_____。
(3)铝和硫酸铜溶液反应的过程如下图2所示:
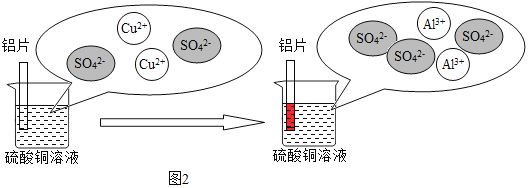
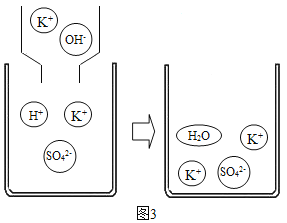
图2烧杯中发生反应的方程式为_____,溶液的质量变化是_____(填写“增大”“减少”“不变”),从微观粒子变化的角度分析铝片在硫酸铜溶液中反应的实质是_____。
(4)如图3所示向KHSO4溶液中滴加KOH溶液,反应的实质是_____。
(5)化学反应前后一定不发生改变的是_____。
A 分子种类
B 原子种类
C 元素种类
D 元素化合价
【答案】溶液红色消失 ![]() (或氢离子和氢氧根离子结合生成水分子) 有气体生成
(或氢离子和氢氧根离子结合生成水分子) 有气体生成 ![]()
![]() 减少
减少 ![]() (或铝原子和铜离子反应生成铝离子和铜原子)
(或铝原子和铜离子反应生成铝离子和铜原子) ![]() (或氢离子和氢氧根离子结合生成水分子) BC
(或氢离子和氢氧根离子结合生成水分子) BC
【解析】
(1)氢氧化钠溶液显碱性,能使无色的酚酞试液变红色,滴加稀盐酸后,氢氧化钠中的氢氧根离子与盐酸中的氢离子结合成水,溶液的碱性减弱,当二者恰好中和时,溶液呈中性,溶液由红色变成无色;
反应的实质是氢离子和氢氧根离子结合生成水;
(2)碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,实验中观察到有气泡产生,反应的实质是碳酸钠中的碳酸根离子与盐酸中的氢离子结合成二氧化碳分子和水分子;
(3)铝和硫酸铜发生置换反应生成铜和硫酸铝,化学方程式为2Al+3CuSO4=3Cu+Al2(SO4)3;由化学方程式可知,每54份质量的铝能置换出192份质量的铜,溶液的质量变小;由微观反应示意图可知,铝片在硫酸铜溶液中反应的实质是2Al+3Cu2+=3Cu+2Al3+;
(4)如图3所示向KHSO4溶液中滴加KOH溶液,反应的实质是氢离子与氢氧根离子结合成水分子;
(5)化学反应前后,分子种类一定改变,原子种类和元素种类一定不变,元素的化合价可能改变,也可能不变。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】工业制取硝酸的流程如下:

(1)步骤①反应属于分解反应,其微观实质是_____ ; 步骤②是利用液态氮与液态氧的_____不同。
(2)步骤③中催化剂所起的作用是_____,相应的化学方程式为_____。
(3)步骤④的化学方程式是![]() ,则X的化学式为_____。
,则X的化学式为_____。
(4)流程中循环使用的物质是_____ (写化学式)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是三种常见固体物质的溶解度曲线,下列说法正确的是
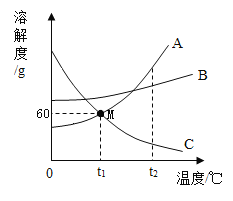
A. t1℃时,A和C的饱和溶液中含有相同质量的溶质
B. 欲除去A溶液中少量的B物质,常采用蒸发结晶的方法
C. t1℃时,将80gA的饱和溶液稀释为质量分数为20%的溶液,需要加水的质童为70g
D. t2℃时,将A、B、C的饱和溶液降温至t1℃,所得溶液的溶质质量分数大小顺序为:B>A=C
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列说法能用质量守恒定律解释的是
A.Yg水受热变为Yg的水蒸气
B.62g红磷和80g的氧气反应生成142g五氧化二磷
C.20g食盐溶于80g水得到100g的食盐水
D.拧开盛酒精的瓶盖一段时间后质量变小
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】科学家研制出一一种,可用于去除装修残留的甲醛(化学式为CH2O),该反应过程的微观示意图如下,下列说法正确的是( )
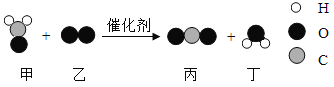
A.物质甲为甲醛,其分子由碳原子和水分子构成
B.物质乙中氧元素的化合价为-2价
C.反应中新型催化剂的化学性质发生改变
D.该反应消耗物质甲和生成物质丁的质量比为5:3
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某工厂产生的烧渣(主要含FeO、Fe2O3,还有一定量的SiO2)可用于制备绿矾(FeSO4·xH2O),工艺流程如下图所示::
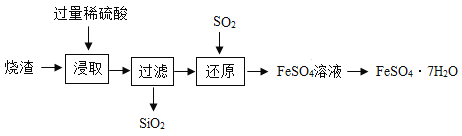
资料1: SiO2不溶于水,也不与稀硫酸反应;
资料2: +2价的铁元素容易被空气中的氧气氧化。
(1)“浸取”步骤中,FeO、Fe2O3和稀硫酸发生反应的化学方程式为:FeO+ H2SO4= FeSO4+ H2O、_________,为提高“浸取”步骤的反应速率,除了采取“搅拌”和“使用催化剂”外,还可采取的具体措施有________(写1条)。
(2)“浸取”、“过滤”步骤后,滤液中的溶质有_________。
(3)“还原”转化的化学反应原理为:SO2+Fe2(SO4)3+2H2O=2FeSO4+2H2SO4,该步骤的主要目的是______。
(4)FeSO4溶液经过蒸发浓缩、______________、过滤、洗涤、低温干燥后得到FeSO4·xH2O晶体;低温干燥的目的是______________。
(5)以上结晶过程最好在氮气环境中进行,氮气的作用是___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组同学利用下图所示装置进行“铝与硫酸铜溶液反应”的实验时,发现反应后试管中的溶液出现分层现象:

【实验现象】
时间 | 观察现象 |
3min | 铝条表面有红色固体出现,铝条所在位置及其上方溶液颜色逐渐变浅,下方溶液没有变化 |
0.5h | 铝条表面聚集大量红色物质,铝条周围溶液呈无色透明,下方溶液仍为蓝色,无色溶液和蓝色溶液界面清晰 |
(1)写出铝和硫酸铜溶液反应的化学方程式___________________。
(2)实验前打磨铝条并将其绕成螺旋状的目的分别是_______________、_______________
(3)根据实验现象判断,铜与铝的金属活动性关系为___________________。
(4)根据反应后明显分层的溶液判断,生成的硫酸铝溶液密度_______(填“>”或“=”或“<”)原硫酸铜溶液密度,根据反应前后物质质量的关系分析,导致这种结果的原因可能是_______________。
附加分:若正确回答下列小题,将获得4分的奖励,但化学试卷总分不超过60分。
(5)为促进铝与硫酸铜溶液反应,在配制硫酸铜溶液时加入少量NaCl。
【提出问题】为什么在硫酸铜溶液中加入NaCl,有利于铝与硫酸铜溶液反应?
【提出假设】Cl的存在有利于铝与硫酸铜溶液反应。
【设计实验】请你设计一个合理的实验验证该假设_______________________________。
除以上方案外,你还能想到的另一种方案是_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com